2008年梅州市初中毕业生学业考试
化学试卷
可能用到的相对原子质量:H―l C―12 O一16 Na一23 Cl一35.5
一、选择题(本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意)
1、日常生产生活中接触到的下列变化,其中属于化学变化的是
A.石油分馏 B.用活性炭净化水
C.灯泡通电发光 D.牛奶变酸
2、下列物质属于有机合成材料的是
A.陶瓷 B.钛合金
C.聚乙烯塑料 D.棉麻织物
3、毕业联欢会上,化学老师出了一条谜语:说是宝,真是宝,动物植物离不了;看不见。摸不着.越往高处越稀少――打一物质名称。这条谜语的谜底是
A.氮气 B.氧气
C.稀有气体 D.二氧化碳
4、王安石的《梅花》诗:“墙角数枝梅,凌寒独自开,遥知不是雪,为有暗香来”。不但描绘了一个如画的意境,也说明了
A.分子可以再分 B.分子之间有间隔
C.分子很小 D.分子在不断地运动
5、世界能源结构如下表所示.其中化石燃料所占百分比为
石油
煤
核能
生物能
天然气
水电及其他
39.6%
22.6%
1.9%
14.2%
16%
5.7%
A.39.6% B.78.2% C.80.1% D.92.4%
6、云吞面是我国南方的一种小吃,俗称“碱水面”,因其在制作过程中加入了“碱水”(呈碱性的物质)而略带涩味。为减少涩味,在吃云吞面时,最好蘸点下列哪种物质
A.食醋 B.花生油
C.食盐 D.白酒
7、下列图示实验操作中,正确的是
8、下图是元素周期表中的一种元素,下列有关该元素的信息正确的是

A.相对原子质量为9
B.原子序数为19
C.该元素的原子核外有9个电子
D.该元素的原子在化学反应中易失去电子
9、北京2008年奥运会火炬“祥云”使用的燃料是丙烷(C3H8),其燃烧的化学方程式为:
C3H8 +
xO2  yCO2+4H2O.其中x、y分别是
yCO2+4H2O.其中x、y分别是
A.5 3 B. 7 3
C.1 3 D. 1 5
10.将X、Y两种金属片分别插人硫酸铜溶液中.X没有发生明显变化,Y表面析出金属铜。据此判断这三种金属的活动顺序是
A. Y>铜>X B.X>铜>Y
C.铜>Y>X D. Y>X>铜
11、中国科学技术大学的化学家在
A.金刚石是一种化合物 B.碳是金属元素
C.该反应中生成了新的原子 D.该反应是置换反应
12、我市提出要“彰显后发优势,实现绿色崛起”。“绿色崛起”是以新型经济为中心,和谐文化为灵魂,友好环境为基础,把梅州丰富的自然资源和良好的生态环境,转化为具有充分社会价值和经济效益的生产要素与发展资本,推动梅州在青山绿水中跨越发展、异军崛起。为配合这一发展战略,你认为下列措施或设想不可取的是
A.完善城市污水收集管网建设
B.加快梅州城区管道天然气项目建设
C.大量使用农药化肥.提高粮食产量
D.实施梅州城区十万群山森林围城工程
13、在水的净化处理中,高铁酸钠(Na2FeO4)是一种新型高效的水处理剂。下列关于高铁酸钠的说法正确的是
A.高铁酸钠是氧化物
B.高铁酸钠中铁元素的化合价为+6价
C.高铁酸钠是一种新型的有机化合物
D.高铁酸钠是由2个钠元素、1个铁元素、4个氧元素组成的物质
14、水与我们息息相关,下列关于水的认识正确的是
A.冰的密度大于水的密度
B.淡水资源取之不尽
C.使用无磷洗衣粉有利于防止水体富营养化
D.硬水与肥皂作用易起泡沫
15、下列有关物质用途的说法中,正确的是
①硝酸铵溶于水制成的冰袋可用于给发烧病人降温
②用小苏打作焙制糕点的发酵粉
③厨房洗涤剂有溶解油脂的作用
④用氯化钠来消除公路上的积雪
A.①③④ B.①②④
C.②③④ D.①②③④
二、(本题包括6小题,共35分)
16、(6分)化学物质与人类的生产生活紧密相关。从氮气、一氧化碳、乙醇、硫酸、熟石灰、硝酸钾等六种物质中,选择适当的物质用化学式填空。
(1)汽车用铅蓄电池中含有的酸是___________。
(2)焊接金属时常用作保护气的是___________。
(3)农田施用的复合肥是___________________。
(4)可用于改良酸性土壤的是_______________。
(5)引起煤气中毒的物质是_________________。
(6)梅州特产长乐烧酒的主要成分是_________。
17、(6分)北京2008年奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。建造“鸟巢”使用了大量的钢铁。
(1)钢铁属于____________(填“纯净物”或“混合物”)。
(2)为了防止钢铁锈蚀,人们常采用在其表面_____________或镀上其他金属等覆盖保护膜的方法。这些方法都能够防止锈蚀的共同原理是_______________________。
(3)把赤铁矿(主要成分是Fe2O3)冶炼成铁的主要反应的化学方程式为________________。
18、(5分)在日常生活中应注意合理摄取营养物质和人体必需的元素。
(1)蔬菜中所含的营养素主要是_____________________。
(2)蛋白质是构成生命的基础物质。是日常膳食的重要组成部分。下列食物中富含蛋白质的是______________________(填序号)。
①葡萄干 ②苹果 ③大豆 ④牛奶 ⑤米饭
(3)糖类是人体所需_____________________的主要来源。
(4)目前市场上有一种叫碘酸钙的保健品,其含有人体必需的微量元素是_______________。
19、(4分)我国北方有许多盐湖,湖水中溶有大量的Na2CO3和NaCl,那里的人们冬天捞碱(Na2CO3),夏天晒盐(NaCl)。Na2CO3和NaCl的溶解度曲线如下图所示,据图回答下列问题:
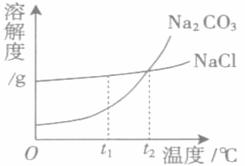
(1)t
(2)等质量Na2CO3、NaCl饱和溶液分别从t
(3)冬天捞碱的原因是由于Na2CO3的溶解度随温度降低而_____________ (填“增大”、“减小”或“不变”)。
(4)夏天晒盐是利用_________________(填序号)的方法,使NaCl晶体析出。
①升高温度,使NaCl溶解度增大 ②风吹日晒.使溶剂蒸发
20、(5分)氢氧化钠是一种重要的化工原料。
(1)氢氧化钠溶液长期暴露在空气中会逐渐变质,检验氢氧化钠溶液是否变质的试剂是____
______________,若已变质则检验时可观察到的现象是______________________。
(2)如果要使氢氧化钠溶液的pH减小,可采取的方法有:
①不发生化学反应的方法_________________。
②有化学反应发生的方法(要求各种方法中所选的物质类别不同)_________________;_______________________。
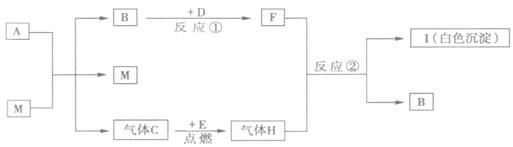
(1)A.M的化学式分别是_________、__________;M的作用是_______________。
(2)写出反应①、②的化学方程式:
反应①____________________________;反应②_______________________________。
(3)实验室检验集气瓶内气体C的方法是_______________________________________。
三、(本题包括2小题,共21分)
22、(12分)下图是实验室中常用的几种装置。
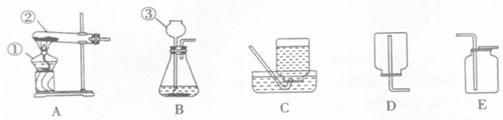
请回答下列问题:
(1)写出有编号仪器的名称:①___________,②________________,③__________________。
(2)实验室用KMnO4制取O2,则应选用的气体发生装置是___________(填装置序号);加入药品前,应首先____________________________。
(3)实验室制取CO2反应的化学方程式为____________________________;制取CO2选用B装置作为气体发生装置的理由是①__________________________,②_________________
____________________________;收集CO2时选用的装置是________(填装置序号)。
(4)某同学欲收集一种难溶性气体.认为下图F装置可以代替C装置,请简述该同学如何使用F装置收集这种难溶性气体_________________________________________。

23、(9分)某研究性学习小组对“SO2能否与H2O反应生成酸”进行探究。请你参与他们的探究活动,并回答有关问题。
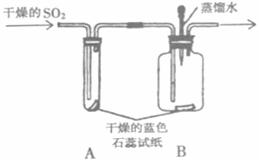
(1)查阅资料:①SO2常温下是一种无色气体,易溶于水;②酸能使蓝色石蕊试纸变成红色;③SO2有毒。
(2)提出假设:SO2能与H2O反应生成酸。
(3)实验探究:设计如上图所示装置进行实验。
①实验过程中,A装置内蓝色石蕊试纸的颜色始终没有变化。A装置的作用___________
_______。
②在通入SO2之前将B装置中胶头滴管内的蒸馏水滴到蓝色石蕊试纸上,未见试纸颜色发生变化,此步操作的目的是______________________________________________________。当有SO2通过时发现湿润的蓝色石蕊试纸变红,此现象说明___________________________,此过程中反应的化学方程式为____________________________________________________。
(4)结论:原假设成立。
(5)反思与评价:该实验方案中,有一个明显的疏漏,请你帮他们指出不足之处____________
______________________________________________________________________________。
(6)拓展探究:该研究性学习小组取刚降到硫酸厂(生产过程中产生SO2)附近的雨水进行测定,每隔几分钟测一次pH,其数据如下表所示:
测定时刻
5:05
5:10
5:15
5:20
5:25
5:30
5:35
pH
4.95
4.94
4.94
4.88
4.86
4.85
4.85
分析上述数据的变化,你可得出的结论是_____________________________;针对此结论,你猜测其中的原因为________________________________________。结合大理石雕像受到酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸(H2SO3)酸性由强到弱的顺序是___________
_________________________________________________________。
四、(本题包括2小题,共14分)
24、(6分)肾病患者需要食用低钠盐的食品,目前市场供应的低钠盐多为苹果酸钠盐 (C4H5O5Na)。请回答:
(1)苹果酸钠盐中各元素的质量比为C:H:O:Na=____________________,苹果酸钠盐中钠元素的质量分数为_____________________________。
(2)
25、(8分)工业上“侯氏”制碱法制得的纯碱产品中常含有少量的NaCl。为测定纯碱产品中Na2CO3的含量,取
(1)所用稀盐酸中溶质的质量分数为____________;
(2)反应后烧杯中的溶液为不饱和溶液,试通过计算求出该溶液中溶质的质量。