2008年长春市中考物理化学综合试卷
化学部分
1.可能用到的相对原子质量:c 12.0―16.Ca一40
2.部分酸、碱、盐的溶解性表(

说明:表中“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水.“挥”表示挥发性,“一”表示那种物质不存在或遇到水就分解了。
一、选择题(本题包括10小题,每小题1分.共10分.每小题只有一个选项符合题意)
1.下列现象中发生化学变化的是
A.纸张燃烧 B.酒精挥发 C.玻璃破碎 D.冰雪融化
2.酥脆的饼干露置在空气中一段时间后变软,原因是空气中含有
A.氮气 B.氧气 C.二氧化碳D.水蒸气
3.下列仪器可以在酒精灯上加热的是
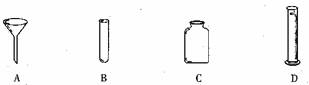
4.下列物质在氧气中燃烧时,能看到浓厚白烟的是
A.氢气 B.硫粉 C.红磷 D.木炭
5.下列有关加碘食盐(含有KIO3)的说法中,正确的是
A. KIO3属于氧化物
B. KIO3中碘的化合价为+2
C.加碘食盐中的碘是指碘单质
D.加碘食盐可预防甲状腺肿大
6.下列有关水分子的说法中,错误的是( )
A.水受热时水分子运动加快 B.水变成蒸气时水分子变大
C.水电解时水分子发生改变 D.水分子是氢原子和氧原子构成的
7.常用的“灭火弹”里装有液态四氯化碳,使用时,液态四氯化碳迅速转化为气态并覆盖在火焰上。据此推测四氯化碳不可能具有的性质是
A.不支持燃烧 B.容易燃烧 C.密度比空气大 D.容易气化
8.下列关于金属的说法中,正确的是
A.篮球架的表面喷涂油漆,主要是为了美观
B.回收金属饮料罐,只是为了减少环境污染
C.银的导电性比锕好,所以常用银作电线而不用铜
D.不锈钢抗腐蚀性好,常用于制医疗器械、炊具等
9.利用化学知识,可以趋利避害。下列说法中.错误的是
A.合理使用化肥和农药有利于保护水资源
B.食品袋内充入氮气能延缓食品变质
C.煤气泄露时向室内洒水能避免一氧化碳中毒
D.限制使用塑料袋有利于减轻“白色污染”
10.下列方案合理的是
A.制备NaOH溶液将饱和的Na2CO3溶液与适量的石灰水混合后过滤
B.检验碳酸根离子:将要检验的物质与稀盐酸混合,观察是否产生气泡
C.鉴别H2、CH4、CO三种气体:分别将燃着的木条伸入集气瓶内,观察现象
D.验证质量守恒定律选用NH4Cl溶液与NaOH溶液,比较反应前后溶液的总质量
二、非选择题(本题包括12小题.第1l一21小题每问1分。第22小题4分.共40分)
11.请回答:
(1)在O、O2、O2-中,表示氧离子的是 ;
(2)氮气的化学式是 ;
(3)下图是氯原子的结构示意图,由此可知,氯原子在化学反应中容易 电子(选填“得到”或“失去”)。
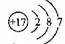
12.化学与生产生活紧密相关。请回答:
(1)用活性炭除去冰箱里的异味。是利用了活性炭的 性;
(2)利用CO的 性,能把赤铁矿石(主要成分是Fe2O3)中的铁冶炼出来。
13.根据下图所示的硝酸钾溶解度曲线:
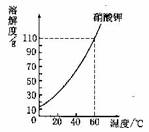
(1)在印℃时,10.g水最多溶解硝酸钾的质量为 g;
(2)在相等质量的水中,要尽可能多的溶解硝酸钾,应选用 (选填“热水”或“冷水”)。
14.在种植蔬菜的大棚里,燃烧秸杆是为了利用生成的CO和草木灰(主要成分是K2CO3)。请回答
(1)CO2能促进植物的 作用,从而提高蔬菜产量;
(2)草木灰用作肥料时.它的作用与 (选填“氮肥”或“磷肥”或“钾肥”)相当;
(3)根据燃烧产物,可以推断秸杆中一定含有钾元素和 元素。
15.请根据常见金属的活动性顺序回答:
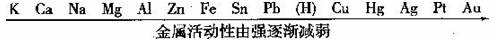
(1)在潮湿的空气中铁容易锈蚀而金不能,这是因为 ;
(2)在镁、铜、锌三种金属中.不能与稀硫酸发生置换反应的是 ;
(3)要比较铜和银的活动性,如果选用了铜,还需选用的一种盐溶液是――。
16. “物质的组成与结构决定物质的性质,性质决定用途,用途体现性质。”根据这一理论回答下列问题:
(1)由于酒精能在空气中燃烧,所以酒精可用作 ;
(2)用墨书写或绘制的字画能够保存很长时间而不褪色,这一事实体现了在常温下碳的化学性质 ,
(3)由于CO分子和CO2分子的 不同,导致它们的化学性质不同。
17.请根据酸、碱、盐的相关知识,回答下列问题:
(1)农业上常用于改良酸性土壤的一种碱是 ,
(2)胃液中含有适量的盐酸。由于胃酸过多而引起的胃痛,可服用含有Mg(OH)2的药物来中和过多的胃酸,发生反应的化学方程式为 ,
(3)用水鉴别NaOH、NaCl、CaCO3三种同体物质时,能够鉴别出NaOH固体所依据的现象是 。
(4)探究稀盐酸、Na2CO3溶液、Ca(OH)2溶液之间能否发生化学反应时,将所有废液倒入同一洁净烧杯中。除指示剂外,最终烧杯中一定含有的一种溶质是 。
18.某小组在实验室里制取CO2时,用到了下列装置,请回答有关问题:
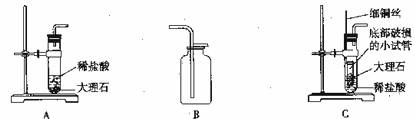
(1)能用B装置收集CO2,是因为CO2的密度比空气 ,
(2)用B装置收集CO2时,检验是否收集满的方法是将燃着的木条放在 ;
(3)将生成的CO2通入石蕊试液中,试液变红,原因是CO2与 反应生成了碳酸;
(4)将A装置改成C装置,通过拉动铜丝可以控制底部破损的小试管升降。这一改进的主要目的是 (选填序号);
A.使反应随时发生或停止 B.使破损的小试管得到利用 C.生成更多的CO2
(5)如果在实验室利用A装置制取氧气,该反应的化学方程式为 。
19.请回答下列与物质提纯有关的问题:
(1)下列两个方案都可以除去铜粉中的少量氧化铜
①用稀盐酸除去氧化铜 ②用CO还原氧化铜
从环境保护和操作简便等方面考虑,较好的方案是 (选填“①”或“②”);
(2)要除去K2SO4溶液中的少量KOH,不能选用稀盐酸,原因是会生成 (填写具体物质的名称或化学式),而引入新的杂质:
(3)要使NaCl溶液中的少量Na2 SO4转化为沉淀而除去,可选用适量的 ,
(4)要除去氢气中的少量水蒸气和氯化氢气体,将混合气体先通过足量的浓硫酸再通过足量的氢氧化钠溶液后,氢气中仍含有的杂质是 。
20.做硫在氧气中燃烧的实验时,在集气瓶内放了少量水来吸收SO2,实验结束后,集气瓶内仍残留一定量的SO2。围绕如何处理这些SO2的问题,同学们进行了相关探究。
【提出问题】
SO2是形成酸雨的主要物质。由此想到,选用氢氧化钠等碱性溶液吸收SO2,效果会怎样?
【设计与实验】
用两套完全相同的装置做对比实验(SO2不溶于植物油也不与其反应),如下图所示:
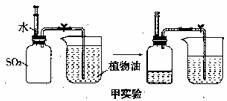
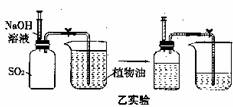
(1)为确保实验的准确性,要先检查装置的 ① ;
(2)实验开始时,先用弹簧夹夹紧乳胶管,再将注射器内等体积的水和NaOH溶液分别注入充满SO2的集气瓶;
(3)充分吸收SO2后,打开弹簧夹,观察实验后进入两个集气瓶内植物油的体积。
【结论与解释】
(1)甲实验中,SO2溶于水且与水反应生成H2SO3,反应的化学方程式为 ② ,
可用 ③ 来测定该溶液的酸碱度;
(2)乙实验中,SO2与NaOH发生反应最终生成NaHSO3;
(3)分析实验现象得知,用碱性溶液比用水吸收SO2的效果 ④ 。
【拓展与迁移】
(1)工业上常用氨水吸收SO2,得到的(NH4)2SO3可用作化肥,但在实验室里吸收SO2,一般选用NaOH溶液而不选用氨水,主要是考虑 ⑤ 性;
(2)在必须用煤作燃料的情况下.要减少SO2的排放,请你提出一条合理化建议: ⑥ ,
21.要配制溶质质量分数为16%的氧化钠溶液
22.CaCO3在高温条件下分解生成CaO和CO2,计算高温分解200gCaCO3生成CaO的质量。