2008年苏州市初中毕业暨升学考试
化学试卷
本试卷分第Ⅰ卷(客观题)和第Ⅱ卷(主观题)两部分,共五大题、30小题,满分100分;考试用时100分钟。
可能用到的相对原子质量:H一
第Ⅰ卷(客观题 共60分)
一、选择题(本题包括20题,每题2分,共40分。每题只有一个选项符合题意。)
1.2008年苏州市以国家《太湖流域水环境综合治理总体方案》根治太湖、阳澄湖等流域水污染问题,以下措施与抑制“水质富营养化”减少总氮、总磷排放量关系最为密切的是
①年内关闭设备落后的化工企业261家,在249个村庄建设生活污水处理设施
②将全面取缔沿太湖
③加大将长江水引入太湖流域的调水力度
④年内拓宽河段
⑤在环太湖
A.①② B.③ C.④ D.⑤
2.超临界水是常态水在湿度超过
A.常态水形成超临界水的过程是化学变化
B.超临界水向固体内部的细孔中渗透能力极强
C.利用超临界水技术治理“白色污染”具有广泛的应用前景
D.超临界水处理废塑料的工艺对设备耐高压、耐高温和耐腐蚀的要求很高
3.实验室中不能被加热的玻璃仪器是
A.试管 B.量筒 C.烧杯 D.锥形瓶
4.在H2O、OH一、H、H+ 四种微粒中,属于分子的是
A.OH一 B.H C.H2O D.H+
5.下列有关营养成分与人体健康关系叙述错误的是
A.缺铁会患贫血症 B.为防治佝偻病,过量补钙
C.摄入淀粉量不足,会患低血糖 D.食用蔬菜、水果可以补充维生素
6.为了防止传染病疫情发生,必须对发生重大自然灾害的地区进行环境消毒,下列有关常用的消毒剂及对应的化学用语表示错误的是
A.熟石灰的化学式:CaOH
B.过氧乙酸结构式: ,其化学式为:C2H4O3
,其化学式为:C2H4O3
C.过氧化氢( )中,氧元素为-l价
)中,氧元素为-l价
D.漂白精有效成份次氯酸钠(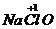 )中,氯元素为+l价
)中,氯元素为+l价
7.下列关于二氧化碳的用途只利用了其物理性质的是
A.二氧化碳用作灭火剂
B.干冰能用于人工降雨
C.二氧化碳能用来生产汽水等碳酸饮料
D.二氧化碳参加绿色植物的光合作用可提高农作物产量
8.关于金属物品的使用正确的是
A.铝合金门窗变旧变暗后用砂纸或钢丝球打磨
B.铁桶中加入硫酸铜溶液和石灰乳配制杀菌剂波尔多液
C.铝壶内的水垢用质量分数为18%的热盐酸长时间浸泡
D.校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈
9.括号内是区别下列各组常见物质的方法,其中错误的是
A.面粉和葡萄糖(加水,振荡) B.硬水与软水(加肥皂水,振荡)
C.蒸馏水与盐水(过滤) D.白酒和食醋(闻气味)
10.下列关于氧气的说法正确的是
A.氧气能支持燃烧,可作燃料
B.氧气能跟所有物质发生氧化反应
C.水中的生物能依靠微溶于水中的氧气而生存
D.带火星的木条一定能在含有氧气的集气瓶中复燃
11.有关尿素[CO(NH2)2]的说法正确的是
A.尿素的相对分子质量为:12+16+14+1×2×2=46
B.尿素是一种有机氮肥
C.尿素中碳、氧、氮、氢四种元素的质量比为:12:16:14:1
D.尿素中氮元素质量分数的计算式为: ×l00%
×l00%
12.下列实验现象和对应的结论描述都正确的是
A.向某固体中滴加稀盐酸.有气泡产生一一该固体一定是碳酸盐
B.在无色溶液中滴入酚酞试液,溶液变红色――该溶液一定是碱溶液
C.生石灰块投入水中,水会沸腾――生石灰变成熟石灰的过程是放热反应
D.向饱和硫酸铵溶液中加入鸡蛋清,产生白色絮状沉淀――蛋白质变性
13.由种类相同的元素组成的一组物质是
A.冰和干冰 B.银和水银 C.烧碱和纯碱 D.水和双氧水
14.下列金属活动性由强至弱的顺序及元素名称、符号均正确的一组是
A.钾K>钙Ca>钠Na>镁Mg B.铝Al>锌Zn>铁Fe>锡Xi
C.铅Pb>铜Cu>贡Hg D.金Au>银Ag>铂pt
15.根据下列微粒的结构示意图(圆圈内“+”号和数字表示带正电的质子的数目,弧线上数字代表各电子层带负电的电子的数目),其中属于阳离子的是
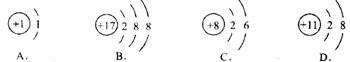
16.下列各组离子在水溶液中能大量共存的是
A.Fe2+、Ca2+、CO32―、OH- B.Na+、SO42―、Cl―、OH-
C.Ba2+、H+、Cl―、OH― D.Ag+、NH4+、NO3-、OH―
17.下列实验操作不当的是
A.将烧碱放在已知质量的烧杯里用托盘天平称量
B.将试管夹从试管底部往上套,夹在试管的中上部
C.振荡试管时,用手紧握试管,拇指堵住试管口,上下晃动
D.滴加液体时,滴瓶滴管的尖端不能触及已加过其它试剂的试管内壁
18.实验室制取下列气体:①用锌和稀硫酸制取氢气;②用双氧水和二氧化锰制取氧气;
③用石灰石和稀盐酸制取二氧化碳气体。下列有关说法错误的是
A.都不需要对气体发生装置加热 B.都可以用排水法收集气体
C.都可用向上排空气法收集气体 D.都可以用相同的发生装置
19.现用质量分数为98%的浓硫酸(密度是1.
A.配制稀硫酸时,用到的玻璃仪器只需量筒和烧杯
B.配制稀硫酸时,一定不能用天平称量所需浓硫酸的质量
C.将480 mL水倾倒入盛有80 mL98%浓硫酸的500 mL量筒中
D.将
20.下图是氢氧化钙的溶解度曲线图。现有

若把该溶液用水浴加热到
A.溶液变浑浊 B.溶液变为不饱和
C.溶液仍饱和 D.溶质质量分数变小
二、选填题(本题包括3题,其20小题,每小题1分,共20分,每小题只有一个选项符合题意。)
21.(8分)世界是物质的、物质是多样的。从下列物质A.陶瓷 B.蛋白质 C.石灰石 D.金刚石 E.纯碱 F.煤炭 G.氨水 H.硝酸铵中,请选择恰当的物质名称前的字母序号填涂在答题卡相应位置。
(1)由原子直接构成的物质 ( )
(2)构成人体细胞的基础物质 ( )
(3)蒸馒头时常用来中和发酵产生的酸.又能起发泡作用的物质 ( )
(4)可以中和工厂排放废水中的硫酸.得到一种氮肥的物质 ( )
(5)常用作建筑材料,又可以炼铁、制玻璃等的物质 ( )
(6)溶于水后会使溶液温度明显降低的物质 ( )
(7)我国古代闻名于世的无机非金属材料 ( )
(8)被称之为“工业的粮食”的化石燃料 ( )
22.(6分)形态各异的物质可按一定规律分类。现有A.石墨 B.二氧化锰 C.氢氧化钾 D.硝酸钾 E.海水 F.硫酸六种物质,请选用各物质名称前的字母序号填涂在答题卡相应位置。
(1)属于非金属单质的是 ;(2)属于氧化物的是 ;
(3)属于易溶性盐的是 ;(4)属于易溶性碱的是 ;
(5)属于混合物的是 ;(6)属于不挥发性酸的是 。
23.(6分)各种物质之间存在着某种联系。用A代替“大于”,B代替“小于”,C代替“等于”,请分别选用“A”或“B”或“C”填涂在答题卡相应位置。
(1)沸点:水 氯化钠鞴溶液;
(2)酸碱度(pH):食醋 肥皂水;
(3)核外电子数:钠原子 氢原子;
(4)含碳量:甲醛(CH2O) 醋酸(C2H4O2);
(5)空气中气体成分的体积分数:氧气 稀有气体;
(6)通常状况下的液体体积:100 mL酒精与100 mL水混合 200 mL。
第Ⅱ卷(主观题 共40分)
三、(本题包括2题,共1 5分)
21.(9分)完成下列反应的化学方程式,并回答有关问题。
(1)宇宙飞船上利用氢气、氧气在催化剂作用下反应作燃料电池:
,在该装置中化学能可以直接转变为 能。
(2)煅烧石灰石制生石灰和二氧化碳:
.该反应是 (选填“吸热”或“放热”)反应。
(3)钢铁厂用一氧化碳还原磁铁矿(主要成分四氧化三铁)炼铁:
(4)某些工厂用稀硫酸清洗铁制品表面的铁锈(主要成分氧化铁):
,溶液由无色变为 色。
(5)将锌粉与氯化银的悬浊液混合充分搅拌,可以生成银和锌盐:
,该反应属于 反应类型。
22.(6分)纯碱在日常生活和化学工业中用途很广,如用于硬水软化、洗涤剂生产、食品加工、石油精炼、粗盐精制、玻璃制造等领域。工业上以食盐、氨气(主要由合成氨厂提供)和二氧化碳为主要原料生产纯碱。其流程如下:
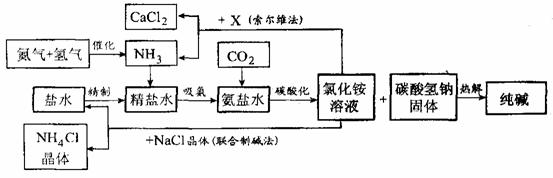
已知有关物质重要反应的化学方程式如下:
①NaCl+NH3+H2O+CO2====NaHCO3↓+NH4Cl
②2NaHCO3 Na2CO3+ H2O+CO2↑
Na2CO3+ H2O+CO2↑
③2NH4Cl +X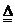 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
④NH4Cl 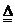 NH3↑+HCl↑
NH3↑+HCl↑
根据以上信息回答下列问题。
(1)盐水精制的过程是除去溶液中各种杂质的过程。为将盐水中含有的Ca2+、Mg2+等沉积,可以向其一和加入过量纯碱.此时将混合液中不溶物除去的方法是 ;溶液中多余的纯碱可以加 试剂来除去。
(2)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通人二氧化碳气体,溶液中会有碳酸氢钠晶体析出。试分析该流程需要加压条件的原因是:
_________ 。
(3)在氨碱工业的历史上.如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”.即在氯化铵溶液中加入物质X (填化学式),产生了可循环使用的氢气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化氨的 ,使氯化铵晶体单独析出得到另一种产品――氮肥.氯化钠溶液则可以循环利用。
(4)在氨碱工业处理剩余的氯化铵溶液时.为何不直接蒸发结晶析出氯化铵固体?
四、(本题包括3题,共17分)
26.(3分)下列实验操作中的先后顺序正确的是 (选填合理选项的字母序号,答案并非唯一)。
A.加热碱式碳酸铜检验气体产物,结束时先将导管从石灰水中移出,再熄灭酒精灯
B.检查气密性时.先旋紧连导管的单孔橡皮塞,将导管插入水中,再用手握住试管
C.用启普发生器制氧气时.先向容器内添加锌粒,再向球形漏斗内注入适量稀硫酸
D.制取氧气时,先将导管伸入倒置于水槽中的集气瓶口.再加热盛高锰酸钾的试管
27.(6分)高锰酸钾是日常生活常用的一种杀菌剂,又称为“PP粉”。它是一种紫黑色固体,取少量固体放入研钵内研磨.做如下图实验。
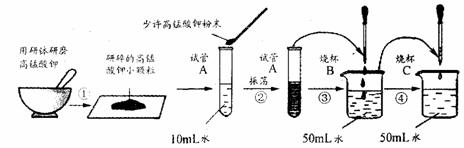
试根据上述实验过程填空。
(1)步骤②将少许高锰酸钾粉末溶于水后得到 色溶液,其中振荡的作用是 。
(2)上述实验中,步骤 (选填实验步骤的序号)说明物质是可分的;步骤④中溶液几乎变为无色。溶液中溶质微粒 (选填“是”或“不是”)变得更小了。
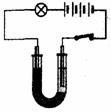
(3)将步骤②所得溶液的一部分倒入U型管内,再加适量水,接入下图所示的电路。闭合电键,发现灯泡发光,这是由于高锰酸钾溶于水时生成了 的缘故。过一段时间后,在与电源相连的两电极区域溶液的颜色深浅出现差异,这又说明高锰酸钾溶液的颜色是由 (填微粒的符号)决定的。
28.(8分)小彤的一副眼镜戴了一段时间后,发现铜质镜架上出现了一墨绿色物质,他想将其除掉。经查阅资料得知:铜在一定条件下会锈蚀生成一种绿色物质,其主要成分是碱式碳酸铜(俗称铜绿),于是他和几个同学按如下方案进行了实验。

试填空
(1)实验①是向铜绿中加入适量常见无色液体B,再加热至沸,沉淀仍然不变色。实验②、③中C是一种常见的无色气体,B的化学式为 。为满足实验③反应所需的外界条件,应该使用关键仪器名称是 。
(2)写出实验②反应的化学方程式 ,
在此过程中,判断铜绿没有完全反应的现象是 。
(3)将A的溶液5~9滴滴入5mL10%的氢氧化钠溶液中得到蓝色絮状沉淀,稍加热即变
黑色沉淀D。写出蓝色絮状沉淀转变为D的化学方程式 。
(4)已知2Ca(HCO3) CaCO3↓+ H2O+CO2↑,则热稳定性CaCO3> Ca(HCO3),由此推理上述实验中铜绿、蓝色絮状沉淀、物质D三种化合物热稳定性由强至弱的顺序是:
CaCO3↓+ H2O+CO2↑,则热稳定性CaCO3> Ca(HCO3),由此推理上述实验中铜绿、蓝色絮状沉淀、物质D三种化合物热稳定性由强至弱的顺序是:
> > (均写化学式)。
(5)经过讨论.同学们建议小彤可以用 除去镜架上的绿色物质。
五、(本题包括2题。共8分)
29.(3分)(本题有a、b两小题,考生任选一题解答,不得两题都解。若两题都解,则以a小题计分)
a.国家“西气东输”工程使得东部沿海地区广大居民用上天然气(主要成分甲烷)作燃料。
已知lkg甲烷燃烧生成液态水和二氧化碳,放出的热量约为5.87×107J。试填空。
(1)参加上述反应的氧气和生我的二氧化碳的化学计量数之比v(O2):v(CO2)= ;(2)若lkg甲烷燃烧生成气态水和二氧化碳放出的热量 5.57×107J(选填“>”
或“<”或“=”);
(3)
b.乙醇是一种清洁能源。乙醇的燃烧可发生以下两个反应:
①C2H6O+3O2 2CO2+ 3H2O
2CO2+ 3H2O
②aC2H6O+5O2 2 CO2+ 2CO+6 H2O
2 CO2+ 2CO+6 H2O
试填空。
(1)反应②中的化学计量数a= ;
(2)反应 (选填化学方程式的序号)属于完全燃烧,产物无毒性。
(3)
30.(5分)食盐不仅是生活必需品.也是生产氯气和烧碱的重要原料。如下图所示,
A(0,26.5);B(14.0,15.0);C(18.8,11.7);D(38.0,2.0).
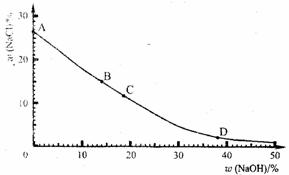
试计算和填空。
(1)
(计算结果精确到小数点后l位)
(2)请列式计算在
(3)若现有