2006-2007学年度潍坊市诸城县第二学期期末考试
八年级化学试题
(时间:90分钟 满分:100分)
可能用到的相对原子质量:
C:12 H:1 O:16 S:32 Zn:65 Cl:35.5 Ca:40 Cu:63.5
第Ⅰ卷(选择题,40分)
一、选择题:(每小题只有一个答案符合题意,请将正确的答案标号填在Ⅱ卷的答案表内。每小题2分,共40分)
1.2005年中央电视台春节联欢晚会上,甘肃省向观众拜年的对联内容为:金银铜铁铬镍铅锌。针对此联,下列说法正确的是
A.这八种元素单质颜色是相同的
B.这八种元素单质均可与稀盐酸反应产生氢气
C.这八种元素均属于金属元素
D.这八种元素在自然界中均以单质形式存在
2.工业生产中常将两种金属在同一容器中加热使其熔合、冷凝后得到具有金属特性的熔 合物一合金。试根据下表所列的金属的熔点和沸点数据(其他条件均已满足)判断,不能制得的合金是
金属
Na
K
Al
Cu
Fe
熔点(℃)
97.8
63.6
660
1083
1536
沸点(℃)
883
774
2200
2795
2750
A.K―Na合金 B.K―Fe合金
C.Na―Al合金 D.Fe―Cu合金
3.下列成语或谚语中,描述金属的化学性质的是
A.斩钉截铁 B.铁杵磨成针 C.铁石心肠 D.真金不怕火炼
4.下列化学反应属于置换反应的是
A.4A1+3O2=2A12O3
B.CH4+2O2 2H2O+CO2
2H2O+CO2
C.2H2O2 2H2O+O2↑ D.2Al+6HCl=2AlCl3+3H2↑
2H2O+O2↑ D.2Al+6HCl=2AlCl3+3H2↑
5.下列关于生铁和钢的叙述中正确的是
A.生铁就是纯净的铁
B.生铁和钢都是混合物
C.钢较软,具有良好的延展性、弹性和机械性能
D.生铁的含碳量低于钢的含碳量
6.钛和钛合金被认为是21世纪的重要材料,它们具有很多优良的性能,如熔点高、密度 小、可塑性好、易于加工,钛合金与人体有很好的“相容性”等。根据它们的主要性能,下列用途不切合实际的是
A.用来作保险丝 B.用于制造航天飞机
C.用来制造人造骨 D.用于制造船舶的主要部件
7.家庭生活中的下列做法不能防止菜刀生锈的是
A.菜刀使用完后,用水洗净,并擦干
B.久置不用时在菜刀表面涂一层食用油
C.把菜刀放在潮湿的地方
D.用不锈钢刀代替普通菜刀
8.下列说法不正确的是
A.回收一个铝饮料罐比制造一个新铝饮料罐成本要高
B.回收铝饮料罐可以节约金属资源
C.回收铝饮料罐可以节约能源
D.回收铝饮料罐可以减少对环境的污染
9.现有下列试剂:①澄清石灰水②食醋③食盐水④纯碱溶液⑤烧碱溶液。其中,检验贝壳的主要成分碳酸盐必须用到的是
A.②⑤ B.①② C.②④ D.①③
10.下列物质中,既可以降低土壤的酸性,又可以配制农药波尔多液的是
A.烧碱 B.纯碱 C.石灰石 D.熟石灰
11.如图所示装置,经数小时后,U型管A、B两处的液面会出现下列哪种情况?
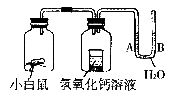
A.A处上升,B处下降 B.A、B两处都下降
C.A、B两处都上升 D.A、B两处都不变
12.即热型快餐盒的内层是铝箔真空包装的食物,外层则分别包装两种物质,使用时拉动留在外边的拉线,使这两种物质反应,便可对食物进行加热。这两种物质最合适的选择是
A.浓硫酸和水 B.生石灰和水
C.熟石灰和水 D.氯化钠和水
13.现代社会生产和生活都需要消耗大量的能量。下列活动中,通过化学反应提供能量 的是
A.风力发电 B.水车汲水灌溉 C.太阳能供热 D.发射航天飞机
14.2007年5月某市发生一起食物中毒事件。经调查取证,事故的起因是将亚硝酸钠(NaNO2)误作食盐使用。NaNO2中氮元素的化合价是
A.+5 B.+4 C.+3 D.+2
15.用下图所示的装置进行质量守恒的实验,反应前后容器内物质的总质量不相等的是
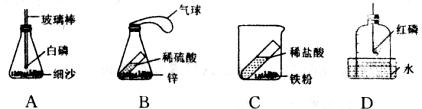
16.铁钉加入下列物质中充分反应后,溶液质量增加的
A.CuCl2溶液 B.FeSO4溶液 C.CuSO4溶液 D.稀硫酸
17.一氧化碳和二氧化碳相比较,下列说法错误的是
A.都是纯净物 B.两者都有毒
C.常温下都是无色气体 D.组成元素相同
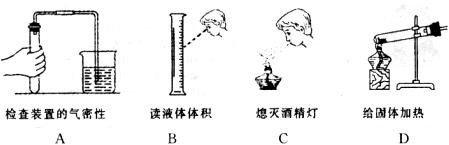
18.以下所示实验操作及实验装置正确的是
19.从石灰抹浆的墙上掉下了一块白色固体,为探究其成分,进行了如下实验:
实验步骤
实验现象
①将固体研磨成粉末状,加水搅拌
固体没有全部溶解
②取上层清液,滴加酚酞试液
溶液呈红色
③取不溶物,滴加盐酸
有气泡产生
由此得出的结论正确的是
A.一定有CaCO3和Ca(OH)2
B.一定有Ca(OH)2,可能有CaCO3
C.一定没有CaCO3和Ca(OH)2
D.一定有CaCO3,可能有Ca(OH)2
20.在杠杆两端分别挂着质量和体积都相同的铝球和铁球,这时杠杆平衡。然后将两个球分别浸在稀硫酸和硫酸铜溶液中片刻,如图所示。则下列说法中正确的是
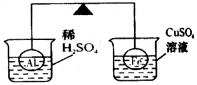
A.铝球一定是空心的
B.左边烧杯中的溶液质量减少了
C.去掉两烧杯后杠杆仍平衡
D.右边铁球出现红色
第Ⅱ卷(非选择题,55分)
二、填空与简答题(共27分)
21.小明在老师指导下,在实验室中用小刀切下黄豆粒大小的一块金属钠投入盛有冷水的烧杯中,发现金属钠在水面上急速转动,发出嘶嘶声,并立刻熔化成一个闪亮的银白色小球,逐渐缩小,最后完全消失。请你根据上述实验现象,帮助小明归纳出金属钠可能有的物理性质:(1)_______________ ,(2) _______________,(3) _______________,
(4) _______________,(5) _______________。
22.下图是同学们经常使用的铅笔,在组成铅笔的各种材料中:

(1)能导电的是(写序号,以下同) _________ ,含有单质的是_________ ,含有有机物的是_________,燃烧时产物中有二氧化碳的是_________。
(2)该铅笔中④的主要成分是金属铝,将一小片该金属放入稀硫酸中,观察到的现象是__________________,反应的化学方程式是____________________________________。
23.在古代,人们把在高温下烧红的铁反复锤打,最终使生铁转化为钢,这也就是所谓的“百炼成钢”的来历。请你写出上述转变过程中最关键一步反应的化学方程式____________________________________。
24.为了验证Cu、Zn、Hg三种金属的活动性顺序,小林同学设计了如下实验:①将Zn粒放入CuSO4溶液中,一会后,Zn粒表面出现红色物质;②将Zn片插入Hg(NO3)2溶液中一会取出,Zn片表面出现银白色金属;③将Cu丝插入Zn(NO3)2溶液中,无明显现象。
(1)小林得出的结论是__________________ ,要得出三种金属的活动性顺序,小林还应该做的实验是_____________________________________________。
(2)为了使实验尽量简化,你认为可用_________步实验就能得出结论,实验内容是______________________________________________________。
25.某银白色固体A在氧气中燃烧,火星四射,生成黑色固体B。如果把A放入稀盐酸中,生成浅绿色的C溶液和气体D。把A投入蓝色E溶液中,发现A表面覆盖一层红色物质F。按要求回答下列问题:
(1)写出A、B、D的化学式和C、E、F的名称:
A_________;B_________;C_________;
D_________;E_________ ;F_________。
(2)写出下列转变的化学方程式:
A在氧气中燃烧___________________________。
A与E反应____________________________________。
26.小明放学回家后,发现奶奶正在用钢丝球擦洗铝锅表面,一会儿铝锅表面就变的光亮如新。小明认为奶奶的做法欠妥,但是不知如何向奶奶说明,请你帮他分析一下:________________________________________________________________________。
三、实验探究题(共17分)
27.小文同学改进一氧化碳还原氧化铁的实验装置如下图所示:

(1)有下列实验步骤:①加热,②通人一氧化碳。则实验开始时,应先______ (填序号),然后_______ (填序号)。若先后顺序颠倒,则可能产生的后果是__________________,产生该后果的原因是____________________________________________________________。
(2)写出A中发生反应的化学方程式________________________________________。
(3)B装置中产生的现象可判断反应是否开始,则B中试剂是____________________。
(4)C装置的作用是_______________________________________________________。
(5)C装置收集气体的方法是____________________,收集到集气瓶中的气体应如何处理________________________________________。
(6)实验结束后,应先____________________,冷却后再____________________。
28.实验室常用金属和酸的反应来制备氢气:
(1)你在选择制备氢气的原料时会从____________________、____________________等角度综合考虑。
(2)若用如图装置制取氢气,则检验此装置气密性的方法是_______________________
______________________________________________________。
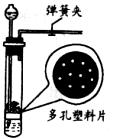
(3)实验时打开弹簧夹,在多孔塑料板上放________,________________由长颈漏斗加入,当不需要反应时,可以________________________,酸液就会被压回长颈漏斗中,使药品分离,反应即自行停止。
(4)若在塑料板上放小块大理石,从长颈漏斗中加入稀盐酸,该装置________ (填“能”或“不能”)用弹簧夹控制CO2的发生和停止。
四、计算题(共11分)
29.碳酸钙和氯化钙的混合物27.8g,加入131g一定质量分数的稀盐酸恰好完全反应生成8.8g气体。则:
(1)原混合物中碳酸钙质量是多少?
(2)反应后所得溶液中溶质的质量分数为多少?
30.为了测定某铜锌合金(即铜锌混合物)中锌的质量分数,某同学利用该合金与稀硫酸反应,进行了三次实验,所得相关实验数据记录如下(实验中的误差忽略不计):
第一次
第二次
第三次
所取合金的质量/g
25
25
50
所用稀硫酸的质量/g
100
160
100
生成氢气的质量/g
0.4
0.4
0.4
(1)上表中第__________次所取的合金恰好与稀硫酸完全反应。
(2)试计算该合金中锌的质量分数。