2007年潍坊市初中学业水平考试
化学试题
注意事项:
1.本试题分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,全卷满分100分,考试时间为90分钟。
2.答第Ⅰ卷前务必将自己的姓名、准考证号、考试科目和试卷类型涂写在答题卡上。第Ⅰ卷每题选出答案后,用2B钢笔把答题卡上对应题目的答案标号(A、B、C、D)涂黑。如需改动,必须先用橡皮擦干净,再改涂其它答案。
可能用到的相对原子质量:H
第Ⅰ卷 (选择题共46分)
一.选择题(本题包括17小量,1-5小题,每小题2分,6-17小题,每小题3分,共46分。每小题只有一个选项符合题意}
1.生活与化学有着密切的联系。以下叙述中只发生物理交化的是
A.用食醋除去热水瓶内壁上的水垢 B.节目燃放焰火
C.绿色植物的光合作用 D.冬季水结为冰
2,随着经济的快建发展,能源的使用量在不断增大.人们的节能意识也日趋增强。下图中属于中国节能标志的是
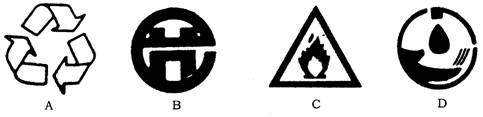
3.科学研究证明:头发的成分能反映一个人的健康状况,健康人的每克头发中约含有:
铁
锌
铝
硼
质量/mg
130
167~172
5
7
这里的铁、锌、铝、硼是指:
A.原子 B.分子 C.元素 D.离子
4.小明到医院检查完身体后,医生建议他多吃水果和蔬菜,请你判断医生让他主要补充的是
A.维生素 B.糖类 C.油脂 D.蛋白质
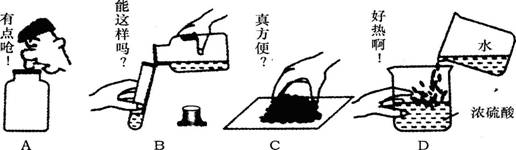
5.化学实验是科学探究的重要手段之一。下图中的操作正确的是
6.某学生查阅资料得到一些食物的近似pH如下表:
食物
苹果
西瓜
牛奶
豆制品
pH
2.9~3.3
5.3~6.3
6.3~6.6
7.4―7.9
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用上述食物中的
A.苹果 B.西瓜 C.牛奶 D.豆制品,
7.燃烧法是测定有机物组成的常用方法。某学习小组取一定质量的某有机物在足量氧气中充分燃烧只得到二氧化碳和水。根据质量守恒定律判断该有机物的组成正确的是
A.只含有C、H两种元素
B.含有C、H、O三种元素
C.一定含有C、H两种元素,可能含有O元素
D.一定含有C、O两种元素,可能含有H元素
8.研究证明高铁酸钠(Na2Fe04)是一种“绿色环保高效”消毒剂,比目前国内外广泛使用的含氯饮用水消毒剂性能更为优良。请你推断高铁酸钠(Na2Fe04)中铁元素的化合价:
A.0 B.+
9.保护环境是每个公民的责任。下列做法有利于保护环境的是
①使用无磷洗衣粉②降低机动车辆的尾气排放③大力推广使用一次性木质筷子
A.①② B.①③ C.②③ D.①②③
10.L-多巴是一种药物,它可用于帕金森综合症的治疗。对该药物的研究,使科学家们分别获得诺贝尔医学奖和诺贝尔化学奖,其化学式为C9H11O4N。下列说法不正确是
A.L-多巴属于有机化合物
B.L-多巴的1个分子中含有25个原子
C.分子中C:H:O:N的质量比为108:11:64:14
D.化学式中氧元素的质量分数为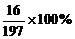
11.炎热的夏天,小林打开冰箱,从
A.
B.室温下,b溶液一定是饱和溶液
C.蔗糖晶体的溶解度随温度的升高而降低
D.a溶液的溶质质量分数大于b溶液的溶质质量分数
12.右图是某个化学反应前后的微观模拟图,请根据图示判断参加反应的○○和●●与反应后生成的 个数比是
个数比是
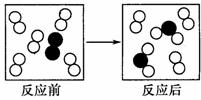
A.5:l:2 B.2:1:2 C.1:l:l D.2:3:1
13.小兵同学在参考书上发现,镁能在二氧化碳气体中燃烧。于是他到实验室里做了如下实验:将镁条用砂纸擦亮,点燃后迅速伸入盛有二氧化碳的集气瓶中,发现镁条剧烈燃烧,发出白光,集气瓶变热,产生一种白色粉末(MgO)和一种黑色粉末(C)。你认为他的结论不正确的是
A.某些金属的燃烧不能用CO2灭火
B.该反应放出热量
C.该反应的实质是Mg与CO2中混有的O2反应
D.该反应是置换反应
14.类推是化学学习中常用的思维方法。下列类推结果不正确的是
A.CaCO3与稀盐酸反应生成CO2,Na2CO3与稀硫酸反应也生成CO2
B.CO能与Fe2O3,反应生成Fe,CO也能与CuO反应生成Cu
C.Fe在潮湿的空气中易被腐蚀,Cu也能在潮湿的空气中被腐蚀
D.NaOH能使无色酚酞试液变红色,Cu(OH)2也能使无色酚酞试液变红色
15.为得到纯净的物质,某同学设计下表中的除杂方法,其中方法正确的是
物质
所含杂质
除去杂质的方法
A
NaCl溶液
Na2CO3
加人稀硫酸至不再产生气泡
B
CuO粉末
C
加入过量稀盐酸,充分反应
C
N2气体
O2
将气体缓缓通过灼热的铜网
D
KCl溶液
CuCl2
加入氢氧化钠溶液至不再产生沉淀
16.按照一定依据把物质进行分类,是研究物质的组成、结构、性质和用途的常用方法。现有三组物质:①金刚石、水银、镁条、干冰;②醋酸、小苏打、食盐、纯碱;③白酒、空气、盐酸、白磷。每组中均有一种物质所属类别与其他三种不同,这三种物质依次是
A.金刚石、小苏打、白酒 B.干冰、醋酸、白磷
C.水银、食盐、空气 D.镁条、纯碱、盐酸
17.某研究性小组设计了下表中的三组实验,分别向甲物质中逐滴加入相应的乙溶液至过量。
①
②
③
田
铜、锌的混合物
硫酸和硫酸铜的混合溶液
盐酸和氯化铵的浓溶液
乙
稀硫酸
氢氧化钠溶液
氢氧化钠浓溶液
反应过程中生成气体或沉淀的质量与加入乙的质量关系,能用右图所示曲线表示的是
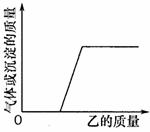
A.①② B.①③ C.②③ D.①②③
第Ⅱ卷 (非选择题 共54分)
二、填空题(本题包括2小题,共l4分)
18.(8分)随着科学的进步,化学与人类健康的关系越来越密切。食品保鲜可以防止食品腐坏,保持食品的营养和味道。食品保鲜的措施有添加防腐剂、充填气体、放干燥剂和脱氧剂等。
(1)包装熟食品时,常加防腐剂苯甲酸钠(C7H502Na),它含有 种元素,其相对分子质量为 。
(2)小包装糕点类食品常采用充气包装。氮气是常用的充填气体,请你根据氮气的性质说明选用氮气的主要原因 。
(3)生石灰是常用的干燥剂,它属于 (填序号)。
A.酸 8.碱 C.盐 D.氧化物
写出生石灰与H2O反应的化学方程式并指出反应类型
(4)某脱氧剂的主要成分为活性铁粉,利用铁与氧气、水反应生成氢氧化铁,来吸收包装袋中氧气和水蒸气,从而延长食品的保质期,写出反应的化学方程式 。
19.(6分)甲、乙是常见元素的单质,A、B是常见的化合物,它们的反应:甲+A→B+乙(式中各物质的化学计量数和反应条件已略去)。请回答:
(1)反应类型是 。
(2)若甲、乙为金属,且乙的硫酸盐溶液为蓝色,写出反应的化学方程式 。
(3)若乙为非金属单质,B中含有+3价金属元素,写出反应的化学方程式 。
三、简答题(本题包括2小题,共l4分)
20.(6分)某学习探究小组用水电解器电解水,测定两管逸出气体的体积,记录如下:
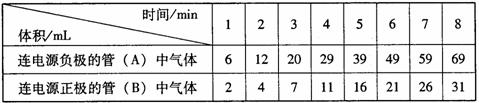
请回答:
(1)写出电解水的化学方程式 。
(2)装置密闭性良好、读数正确,但电解开始阶段两管气体的体积比不符合理论比值的原因是 。
(3)自第 分钟起管(A)和管(B)产生气体的体积比非常接近理论比值。
21.(8分)已知A、B、C、D、E、F、I、X是初中化学中常见的物质,其中A、B含有相同的元素,B、D、E、X为氧化物,F是最简单的有机物,C、I为单质。
它们相互转化的关系如右下图所示(图中反应条件已略去)。请回答:
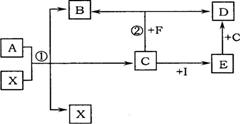
(1)X在反应①中起的作用是 。
(2)A的化学式是 。
(3)写出反应②的化学方程式
。
(4)实验室检验气体D的方法是 。
四、实验与探究题(本题包括2小题,共l8分)
22.(8分)山东省海域辽阔,盛产海带,海带中含有丰富的碘。为了从海带中提取碘,某研究小组设计并进行了以下实验:
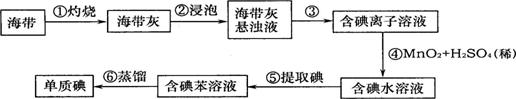
请你填写下列空白:
(1)步骤①灼烧海带时,除需要坩埚、泥三角、三角架外,还需要用到的一种仪器是
(填写序号)。
A.烧杯 B.酒精灯 C.研钵 D.干燥器
(2)步骤②浸泡中,使用了玻璃棒,其作用是 。
(3)步骤③的实验操作名称是 ,该操作中除用到铁架台、烧杯、滤纸外,还用到的仪器是 、 。
(4)实验中用到托盘天平,在使用时,先 ,然后把称量物放在 盘,要用 夹取砝码放在另一盘中。
23.(10分)含镁3%~5%的镁铝合金是轮船制造、化工生产、机械制造等行业的重要原材料。现有一块质量为w g的镁铝合金,某研究性学习小组欲测定其中镁的质量分数。
【查阅资料】已知铝与NaOH溶液反应生成易溶于水的偏铝酸钠(NaAlO2:)和H2,化学方程式为: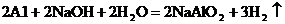 ;镁不与NaOH溶液反应。氢氧化铝能与氢氧化钠溶液发生反应生成易溶于水的偏铝酸钠(NaAlO2:)和H2O,化学方程式为:
;镁不与NaOH溶液反应。氢氧化铝能与氢氧化钠溶液发生反应生成易溶于水的偏铝酸钠(NaAlO2:)和H2O,化学方程式为: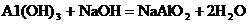 ;氢氧化镁不与氢氧化钠溶液反应。
;氢氧化镁不与氢氧化钠溶液反应。
【提出猜想】利用镁铝与酸、铝与碱、氢氧化铝与碱反应的化学性质来测定合金中镁的质量分数。
【设计方案】研究小组设计了不同的实验方案。
方案l:镁铝合金与过量盐酸反应测定生成气体在标准状况下的体积为V
方案2:镁铝合金与过量NaOH溶液充分反应后,过滤、洗涤、干燥、称量剩余固体的质量为w
方案3:镁铝合金与过量盐酸溶液反应后再与过量NaOH溶液反应,过滤、洗涤、干燥、称量沉淀的质量为w
【问题讨论】请你参与研究小组的研究过程,并回答有关问题:
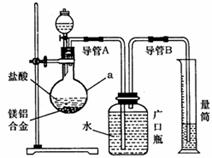
(1)研究小组利用上图所示实验装置,按照方案1进行了实验。
①装置中仪器a的名称是 。
②实验装置中有一处明显错误,请指出
(2)方案2中剩余固体是 ;若按方案2进行实验,测得镁的质量分数为 。
(3)方案3中“过滤”得到的沉淀是 。
(4)某同学又设计了与上述方案原理不同的方案4,也能测得镁的质量分数。请你在横线上填写合适的内容,将该方案补充完整。
方案4:镁铝合金与
反应测定生成气体在标准状况下的体积为V
【方案评价】
(5)在实验方案1―4中,你认为最佳的实验方案是 。
五、计算题(本题包括l小题。共8分)
24.(8分)我市北临渤海湾,是全国重要的产盐区。下图是某盐场生产并处理过的工业盐产品质量指标。某学习小组为了测定该工业盐中氯化钠的质量分数,进行如下实验:①取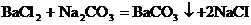 l)。求:
l)。求:
(1)
(2)通过计算,判断该工业盐中氯化钠的质量分数是否符合产品质量指标。(计算结果保留2位小数)
