2007年聊城市莘县中考模拟考试三
化学试题
注意事项:
1.物理、化学、生物实行联考,试题分值共150分。考试时间120分钟。
2.本试卷分试题和答卷两部分。答案直接写在答卷上,考试结束时只交答卷,不交试题部分。
可能用到的相对原子质量C:12 H:1 O:16 N:14 Mg:24 Fe:56 S:32 Zn:65
一、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个选项符合题意,将它的编号填入答卷对应的空格中。)
1、化学家在当今环境问题上的最新构想是“变废为宝,资源循环”。例如,燃料(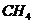 、
、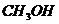 等)
等) 燃烧产物(
燃烧产物(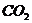 、
、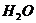 )
) 燃料(
燃料(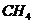 、
、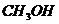 等),这样既能解决能源危机,又能消除污染。上述构想中的①、②两个转化过程的变化为
等),这样既能解决能源危机,又能消除污染。上述构想中的①、②两个转化过程的变化为
A.均为物理变化
B.均为化学变化
C.①为物理变化,②为化学变化
D.①为化学变化,②为物理变化
2.NO是大气污染物之一,但少量NO在人体内具有扩张血管、增强记忆的功能。NO难溶于水,通常条件下极易与氧气反应。实验室收集NO的装置是
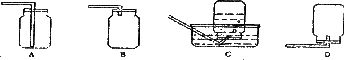
3.下列实验现象所描述的变化正确且该反应属于置换反应的是
A.铁丝在氧气中燃烧,火星四射,生成黑色固体
B.镁粉与稀硫酸混合后,溶液颜色无明显变化,但迅速产生气泡
C.一氧化碳与灼热的黑色氧化铜粉末接触,粉末逐渐变红
D.盐酸中滴入硝酸银溶液后,有白色沉淀生成
4.用下列溶液分别滴入NaOH溶液、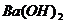 溶液和稀
溶液和稀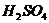 中,产生三种不同现象的是
中,产生三种不同现象的是
A.无色酚酞试液 B.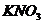 溶液 C.
溶液 C.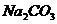 溶液
D.
溶液
D.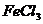 溶液
溶液
5.试管内壁附着的下列物质不能用稀盐酸浸泡除去的是
A.盛石灰水后留下的白色固体
B.用足量的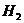 还原
还原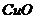 后留下的红色物质
后留下的红色物质
C.氯化铁溶液与氢氧化钠溶液反应后留下的红褐色固体
D.用CO还原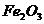 后留下的黑色物质
后留下的黑色物质
6.工业盐酸因含有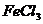 而显黄色,现向1-2ml工业盐酸中逐滴滴加NaOH溶液,其加入量(X)与生成沉淀量(Y)的关系应是:
而显黄色,现向1-2ml工业盐酸中逐滴滴加NaOH溶液,其加入量(X)与生成沉淀量(Y)的关系应是:
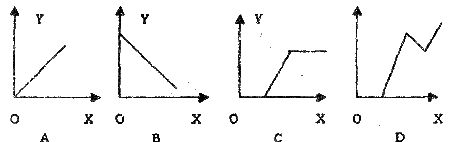
7.某溶液中含n个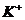 、n个
、n个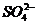 、n个
、n个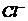 ,除存在不等量的
,除存在不等量的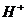 和
和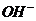 外,别无其它离子存在,请你推测此溶液
外,别无其它离子存在,请你推测此溶液
A.pH>7 B.pH=7 C.pH<7 D.pH≥7
8.若将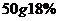 的NaOH溶液与
的NaOH溶液与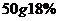 的盐酸混和,下列叙述正确是
的盐酸混和,下列叙述正确是
A.混合溶液的pH=7
B.溶液混合前后的温度不变
C.混合溶液的质量为100g
D.混合溶液中生成物的溶质质量分数仍为18%
9.在一密闭容器中有A、B、C、D四种物质,一定条件下使之反应,一段时间后。测得反应前后各物质的质量如右表所示。则该密闭容器中发生的化学反应类型为
物质
A
B
C
D
反应前质量/g
90
10
8
2
反应后质量/g
ll
59.25
29.75
10
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
10.有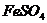 、
、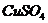 的混合溶液,向其中投入一些锌粉,完全反应后得到一些固体沉淀。过滤向沉淀中加入少量稀硫酸有气泡产生。对上述固体沉淀有下列说法,其中正确的是
的混合溶液,向其中投入一些锌粉,完全反应后得到一些固体沉淀。过滤向沉淀中加入少量稀硫酸有气泡产生。对上述固体沉淀有下列说法,其中正确的是
①一定含有Zn ②一定含有Fe ③一定含有Cu
④可能含有Zn ⑤可能含有Fe ⑥可能含有Cu
A.①②③ B.②③④ C.③④⑤ D.①②⑥
二、填空题(包括4个小题每空1分,共12分)
11.(3分)t℃时,将3g生石灰加入到60g a%的饱和石灰水中,保持温度不变,所得溶液的质量(填:“<”、“>”、“=”,下同)_______60g,溶液中溶质的质量分数_______a%;若将该溶液的温度升到,此时所得溶液中溶质的质量分数__________a%。
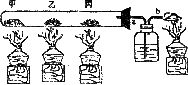
12.(2分)将适量氧化铜固体、少量氯酸钾粉末、足量炭粉分别放入如图所示大试管中,对甲、乙、丙三个部位进行加热,每一个部位只放一种固体,乙处粉末呈黑色,随着反应的 进行,要能得到单质铜。
甲、丙两部位各放固体是:
甲:____________ 丙:_____________
13.(3分)鱼是人们非常喜爱并经常食用的食品。剖鱼时若不小心弄破了鱼胆,胆汁沾在鱼肉上,就会使鱼肉带有苦味而影响人的食欲.胆汁中:其有苦味的物质主要是胆汁酸(一种酸),沾在鱼肉上的腮汁酸很难用水洗掉。
(1)根据上面的描述,请你写出胆汁酸的一种物理性质_____________。
(2)为除去沾在鱼肉上的胆汁酸,消除鱼肉的苦味,可用厨房中常用的一种物质的溶液浸泡,这种物质是________,若用HR表示胆汁酸的化学式,则浸泡过程中发生反应的化学方程式为____________________________________________________.
14.(4分)若取质量均为mg镁和铁,分别投入到50g溶质质量分数相同的硫酸中,充分反应均产生0.2g氢气。可推断出:
①充分反应后,一定有剩余的金属是___________________;②m的取值范围为__________,反应中消耗掉金属镁的质量为__________________;③硫酸中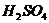 质量分数为_______。
质量分数为_______。
三、实验与探究题(本大题包括2小题,共10分)
15.(4分)某校化学课外活动小组的同学为确定一包黑色粉末的成分,按图装置进行实验,其中X是制取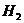 的装置。
的装置。
(1)常温下,铝片与氢氧化钠溶液反应也能生成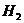 ,若利用此反应制取氢气,X应选择____________装置(填字母代号)。
,若利用此反应制取氢气,X应选择____________装置(填字母代号)。
(2)将(1)中所制 通入玻璃管前,需先通过D装置,D装置的作用_____________。
通入玻璃管前,需先通过D装置,D装置的作用_____________。
(3)加热玻璃管一段时间后,管内黑色粉末完全变为红色固体,且烧杯内澄清石灰水变浑浊,已知黑色粉末是两种物质的混合物,则其成分为__________________________。
(4)写出A装置中玻璃管内发生的化学方程式为___________________________。
16.(6分)小强、小明和小梅三同学在学习了木炭还原氧化铜的实验后,提出如下问题:“木炭与一氧化铅(化学式为PbO)反应生成铅的同时产生的气体一定全部为二氧化碳吗?请你和他们一起对产物中气体的成分进行研究,并回答有关问题。
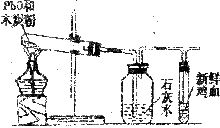
A B C
(1)猜想:小强认为:反应产生的气体全部为二氧化碳。小明认为:反应产生的气体全部为一氧化碳。小梅认为:反应产生的气体既有二氧化碳又有一氧化碳。
(2)设计实验:根据各自的猜想,他们共同设计了实验,实验装置如右图(他们在实验中进行了规范操作和细致的观察)。
(3)现象与结论:如果小强猜想正确,装置B、C中的实验现象是___________________;如果小明猜想正确,装置B、C中的实验现象是____________________________。如果小梅猜想正确,装置B、C中的实验现象是______________________________________。
(4)此实验装置有不足之处,请你对该装置进行改进,具体措施是___________________。
(5)根据上述实验及学习的木炭与CuO、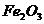 的反应,请你归纳出单质碳的一项重要用途是_________________________________________________________________。
的反应,请你归纳出单质碳的一项重要用途是_________________________________________________________________。
四、计算题(本题包括1小题,共8分)
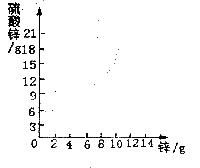
17.用锌片与稀硫酸反应,六个实验结果记录如下:
次数
加入锌的质量/g
稀硫酸/g
生成硫酸锌的质量/g
一
2
60
5
二
4
60
( )
三
6
60
15
四
8
60
17
五
10
60
( )
六
12
60
17
(2)在图上画出硫酸锌与锌的质量函数关系的曲线;
(3)若使(10+m)g锌与60g稀硫酸充分反应后,求剩余固体的质量。
(4)求稀硫酸的质量分数。(注意:本题结果均取整数,后两小题要求计算过程)
(1)将第二、第五次产生硫酸锌的质量填于下表相应的括号内;