2007年烟台市海阳初中四年级摸底考试
化学试卷
说明:1.本试题分I卷和Ⅱ卷两部分,I卷为选择题,Ⅱ卷为非选择题。
2.满分100分;考试时间为90分钟。
3.使用答题卡的考生。将选择题答案用2B铅笔填涂在答题卡上,需要改动的请用橡皮擦净后再涂写清楚。
4.不使用答题卡的考生。请将选择题答案填写在Ⅱ卷中的答题表中。
5.考试结束后。只交Ⅱ卷不交I卷。
第I卷(选择题,共30分)
可能用到的相对原子质量:H
Cl 35.5 Fe 56 Cu 64 Zn 65
一、选择题(本题包括10个小题,每题1分,共10分。每小题只有一个选项符合题意)
1.2005年,我国科学家成功实现首次单分子自旋态控制,这是世界上首次实现单个分子内部的化学反应。单个分子内部的化学反应中发生变化的是
A.原子个数 B.原子种类 C.分子种类 D.元素种类
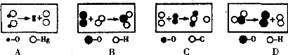
2.从分子、原子的角度认识化学反应是创造新分子的基础。下图中●、O分别表示不同元素的原子。图中表示的反应与实际相符的是
3.保护环境是每一个公民的责任。下列做法:
①推广使用无磷洗涤剂,
②城市生活垃圾分类处理,
③推广使用一次性木质筷子,
④推广使用清洁能源,
⑤过量使用化肥、农药,
⑥推广使用无氟冰箱。其中有利于保护环境的是
A.①②④⑤ B.②③④⑥ C.①②④⑥ D.③④⑤⑥
4.葡萄糖(C6H12O6)供给人体活动和维持体温所需能量的反应可表示为:C6H12O6+O6→6CO2+6H2O下列分析错误的是
A.医疗上可用一定质量分数的葡萄糖溶液补充能量
B.葡萄糖缓慢氧化转变成二氧化碳和水,同时产生能量
C.人呼出的气体和吸入的空气的成分相比,CO2和H2O的含量增加,O2的含量减少
D.葡萄糖氧化产生的CO2如不能及时排出人体,则血液的pH值将增大
5.同一化学反应进行的快慢与很多因素有关。现用
A.减少双氧水的用量 B.加水稀释
C.逐滴加入双氧水 D.降低温度
6.你经常做家庭小实验吗?根据你的经验,下列小实验不能成功的是
A.用铜丝等材料探究铜生锈的条件
B.用食盐水浸泡菜刀去除表面的锈斑
C.用碳酸饮料做二氧化碳的性质实验
D.用废电池的“锌皮”与食醋反应制氢气
7.图表资料可以提供很多信息,下面是某学生对图表资料的使用,其中不正确的是
A.根据金属活动性顺序表,判断金属能否置换出稀硫酸中的氢
B.根据密度数据表判断液体物质挥发性的大小
C.根据溶解度曲线图,判断从溶液中获得晶体的方法
D.根据酸、碱、盐的溶解性表,判断某些复分解反应能否进行
8.手机使用的锂电池是新型的高能电池,以质量轻、电容量大而受到青睐。某种锂电池的总反应可表示为Li+MnO2=LiMnO2。下列说法中正确的是
A.LiMnO2为新型的氧化物 B.LiMnO2为锂、锰、氧的合金
C.该反应属于化合反应 D.该反应中Mn的化合价没有变化
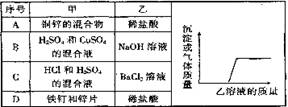
9.向下表中的甲物质中逐滴加入相应的乙溶液至过量。反应过程中生成气体或沉淀的质量与加入乙的质量关系能用表中右图表示的是
10.现有不纯的锌
A.Mg和Cu B.Fe和Al C.Al和Mg D.Cu和Mg
二、选择题(本题包括10个小题。每题2分,共20分。每小题有一个或两个选项符合题意。若有两个答案,漏选一个扣1分。错选不得分)
11.下列是四位同学分别设计的实验方案,你认为可行的是
A.某白色固体化合物溶解于水,向所得的无色溶液中滴入几滴酚酞试剂。溶液呈红色,证明该白色固体化合物一定是碱
B.向某无色溶液中加入氯化钡溶液,产生白色沉淀,再加稀硝酸,白色沉淀不溶解,证明该无色溶液中一定含有硫酸根离子
C.不用其他试剂就可鉴别氢氧化钠、氯化镁、硫酸铜和硝酸钾四种溶液
D.把燃着的木条插入某瓶无色气体中,木条熄灭,证明瓶中的气体一定是二氧化碳
12.某城市有甲、乙两工厂排放污水,污水中各含有下列6种离子中的3种(两厂不含相同离子):Ag+、Ba2+、Na+、Cl-、SO42-、NO3-。若两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便会变成无色澄清只含有硝酸钠的液体.污染程度会大大降低。关于污染源的分析,你认为正确的是
A.Na+和NO3-来自同一工厂
B.Cl-和NO3-一定不在同一工厂
C.Ag+和Na+可能在同一工厂
D.SO42-和NO3-可能来自同一工厂
13.小王在家里用鸡蛋壳与盐酸反应,证明鸡蛋壳里是否含有CO32-(装置如右图所示),实验后小王进行了如下归纳与推测,其中正确的是
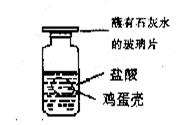
A.若有气泡产生且玻璃片上出现浑浊。说明鸡蛋壳里可能含C032-的浓度过大
B.能与盐酸反应产生大量气体的物质中一定含CO32-
C.若玻璃片上的石灰水没有变浑浊,说明鸡蛋壳里没有CO32-
D.若玻璃片上的石灰水没有变浑浊,有可能是盐酸的浓度过大
14.下列说法你认为正确的是
A.如果两种粒子属于同一种元素,则它们原子核中的质子数二定相同
B.如果两种粒子含有相同的质子数,则它们一定属于同一种元素
C.由同一种元素组成的单质性质相同
D.如果两种粒子含有的电子数相同,则它们一定属于同一种元素
15.下列选项中都有I、Ⅱ、Ⅲ三种溶液,在Na2CO3溶液中加入I溶液,产生白色沉淀,再加入Ⅱ溶液,沉淀溶解并有气泡产生,然后再继续加入Ⅲ溶液,又产生白色沉淀。符合上述变化的选项是
I
II
III
A
CaCl2
HNO3
KCI
B
CaCl2
HNO3
AgNO3
C
BaCl2
H2SO4
CuCl2
D
BaCl2
HNO3
Na2SO4
16.小华将一张滤纸在某指示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色,再将其悬挂与铁架台上,并在滤纸的下方(如右图)放置一盛有某溶液的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂和烧杯中的溶液分别是
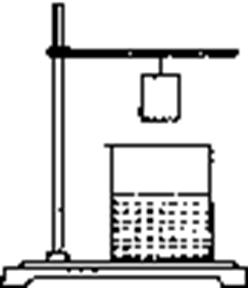
A
B
C
D
滤纸上的指示剂
酚酞试液
酚酞试液
石蕊试液
石蕊试液
烧杯中的溶液
浓氨水
浓盐酸
浓氨水
浓盐酸
17.有一种酸碱理论,称为质子理论,这种理论把凡是能给出质子(H+)的分子或离子定义为酸;凡是能接受质子的分子或离子定义为碱。按这种酸碱理论,下列物质中不属于碱的是
A.NH4+ B.CO32- C.SO42- D.HCI
18.把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如下表所示:
物质
A
B
C
D
反应前质量/g
19.7
8.7
21.6
0.4
反应后质量/g
待测
17.4
0
0
3.6
下列说法正确的是
A.物质C一定是化合物,物质D可能是单质
B.反应后密闭容器中A的质量为
C.反应过程中,物质B和物质D变化的质量比为87:36
D.若物质A与物质C相对分子质量之比为194:216。则反应中A和C的化学计量数之比为l:2
19.向
A.2:1:75 B.2:1:
20.某同学利用一种黑色粉末(含氧化铜、炭粉、铁粉中一种或多种)和未知溶质质量分数的稀硫酸,做如下探究:将ag黑色粉末加入到盛有
A.反应后不可能得到红色固体
B.黑色粉末中含有铁粉,加人黑色粉末质量一定为
C.若反应后黑色粉末无剩余.则黑色粉末中一定不含有炭粉
D.该稀硫酸中溶质的质量分数不低于19.6%
第Ⅱ卷(非选择题,共70分)
注意事项:答卷前先将密封线内的项目填写清楚
可能用到的相对原子质量:H
三、填空题(本题包括5个小题。共17分)
21.某元素原子结构示意图如右图所示:
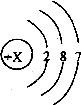
x的数值是 ,根据元素原子结构示意图,不能直接获得的信息是 (填编号)。
①核电荷数 ②相对原子质量 ③电子层数 ④最外层电子数
22.物质的分类标准有多种,可以是物质的组成、性质、用途等。请参考示例,自拟两种至少包含两种物质的标准,将标准以及符合该标准的物质填写在表格中。
给下列物质分类
标准
符合该标准的物质
小苏打、钛、葡萄糖、氯化铜、乙醇、水银、氨气
(1)示例:易溶于水
(2)
(3)
23.
(1)火箭推进器中盛有强还原剂联氨(N2H4)和双氧水(H2O2),它们混合时产生水蒸气和一种单质,并放出大量的热,其反应的化学方程式为 ;将联氨作推进器中燃料的一个很大优点是 。
(2)宇宙飞船中用来除去二氧化碳的物质是氢氧化锂(LiOH),其反应原理是 ;用氢氧化锂而不用其他物质(如氢氧化钠)的原因是 (通过计算说明) 。
24.粉笔是教室内空气的主要污染物(可吸入颗粒物),粉笔的生产过程是:
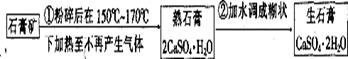
(1)写出熟石膏变成生石膏的化学方程式。
(2)在熟石膏中加入少量的甘油和纯碱,可制成“无尘”粉笔,这是利用甘油吸湿性很强的性质,可使粉笔因潮湿而不飘尘。而加入纯碱的作用是提高粉笔的硬度。其原理用化学方程式表示为 。
25.将一种盐溶于水,会使水的冰点(凝固点)降低,冰点降低多少与盐在溶液中的质量分数有关。如果将此盐溶液降温。则在零度以下某温度会析出冰。但当盐在溶液中的质量分数比较大时,在将溶液冷却的过程中先析出的固体不是冰而是盐的晶体。如图所示,横坐标为氯化钙溶液中溶质的质量分数,纵坐标为温度,试填空或简答:
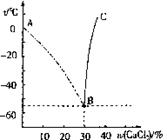
(1)氯化钙溶液可用作冷冻剂,当无水氯化钙与水混合的质量比为 时(填写最简整数比),冷却效果最好。
(2)指出两条曲线分别表示的具体含义:
曲线AB: ;
曲线BC: 。
(3)将
A.此时溶液处于不饱和状态
B.溶液中析出了氯化钙晶体
C.溶液中已经有冰析出
D.此时冰、氯化钙晶体和氯化钙饱和溶液共存
E.此时氯化钙晶体和氯化钙饱和溶液共存
四、简答题(本题包括2个小题,共15分)
26.自然界的矿物中有一种重晶石矿,它的主要成分是BaSO4,它不溶于任何酸、碱和水,纯净的硫酸钡可供医疗等方面应用。某同学用重晶石和焦炭为原料,制取纯净硫酸钡,部分流程如下(设矿物中杂质不与焦炭反应,也不溶于水):
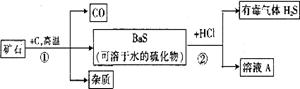
(1)步骤①中,哪些元素的化合价升高,哪些元素的化合价降低? ;
(2)步骤②中溶液A中溶质的化学式: ;
(3)写出利用溶液A中的溶质为主要原料制取BaSO4的化学方程式: ;
(4)步骤②产生有毒气体H2S,应加以改进,为使实验既不产生H2S又能获得纯净BaSO4,请你提出改进意见 ;有关反应的化学方程式是 。
27.小明、小鹏和小芳三位同学在一起探究蜡烛燃烧,他们将短玻璃导管插入焰心,发现另一端也可以点燃。
(1)【提出问题】导管里一定有可燃性气体,气体成分可能会是什么呢?
(2)【猜想】小明认为:可能是蜡烛不完全燃烧时产生的CO。
小鹏认为:可能是蜡烛受热后产生的蒸气。
小芳认为:可能上述两种情况都有。
(3)【设计实验方案】请你帮助他们设计一个简单的实验方案,来判断哪一种分析是正确的_____________________________________________________________________________。
(4)【现象与结论】如果小明的猜想正确,现象应是 。
如果小鹏的猜想正确,现象应是 。
如果小芳的猜想正确,现象应是 。
(5)如果用CnH2n+2表示蜡烛的主要成分,其燃烧的化学方程式为: 。
28.小明同学在使用“除垢净”去除热水壶中的水垢时,发现有大量的气泡产生,联想水垢的主要成分是碳酸钙。小明猜想“除垢净”的成分中可能有酸。
①为证实自己的猜想,小明从家中又找来两类不同的物质进行实验:
实验一: ;
实验二: 。
经实验,小明得出“除垢净”的有效成分中一定有酸的结论。
②小明想试制一瓶“除垢净”,你认为HCl、H2SO4两种酸中的 更合适,理由是 。
③结合上面对“除垢净”的了解,在使用“除垢净”时应注意 。
五、实验与探究(本题包括4个小题,共30分)
29.甲酸(HCOOH)通常是一种无色易挥发的液体,它在浓硫酸作用下易分解,反应方程式为:HCOOH CO↑+H2O。某课外活动小组的同学欲用该反应来制取CO,并还原红棕色的氧化铁粉末。现有下列仪器或装置供选择:
CO↑+H2O。某课外活动小组的同学欲用该反应来制取CO,并还原红棕色的氧化铁粉末。现有下列仪器或装置供选择:
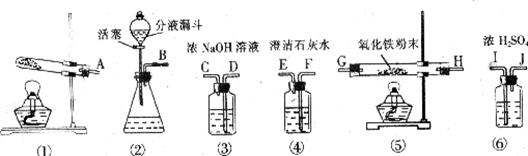
(1)用甲酸滴入浓硫酸的方法制取CO,应选 (填序号)装置;如果要除去CO气体中混有少量的甲酸,最好选择上图中 (填序号)进行洗气。
(2)用上述方法制取的CO还原氧化铁,并检验气体产物,则各仪器的接口连接顺序为 ___________________________________________(填字母)。
(3)在对氧化铁粉末加热前,为安全起见,应进行的一项重要操作是 。
(4)从开始加热到实验结束,氧化铁粉末的颜色变化为 ,反应方程式为 。
(5)上述实验的尾气不能直接排放到空气中,请你说出一种处理尾气的方法: 。
30.某同学将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液,并对滤液的组成进行探究。
(1)锌和硝酸银溶液反应的化学方程式 。
(2)同学们对滤液中所含的溶质做出多种猜想,其中有两种猜想可能成立,这两种猜想是:
①溶质为 ;②溶质为 。
方案
实验操作
实验现象
结 论
方案一
猜想 成立
方案二
猜想 成立
31.【研究课题】:探究热水壶底部水垢的主要成分
【查阅资料】:该小组同学通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO3-等离子,在加热时,这些离子趋于生成溶解度更小的物质――水垢(主要成分为碳酸盐、碱的混合物)。同时,他们还查阅到下列有关物质的溶解性:
物质
Ca(HCO3)2
Mg(HCO3)2
Ca(OH)2
Mg(OH)2
CaCO3
MgCO3
溶解性
可溶
可溶
微溶
不溶
不溶
微溶
【提出猜想】:水垢的主要成分一定含有Mg(OH)2和 ,可能含有Ca(OH)2和 。
【设计方案】:
(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,取上层清液加入 ,没有白色沉淀,说明水垢中无Ca(OH)2;
(2)乙同学设计下列实验装置,进一步确定水垢中含有碳酸盐的成分,步骤如下:
①按图组装仪器,将
②测量一定时间内干燥管内物质增加的质量(见下列曲线);
③待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
④再次称量干燥管内物质增加的质量;
⑤重复③和④的操作,直至干燥管内物质质量不变。
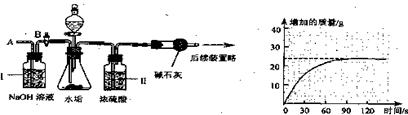
a.步骤①所加的酸溶液是 ;
b.装置Ⅱ的作用是 ;从导管A处缓缓鼓人一定量的空气时,装置I的作用是 ;
c.研究性小组的同学经过简单计算,认为水垢中一定含有MgCO3,理由是 。
【实验结论】通过上述探究可知:水垢的主要成分有 。
81.5
35.8
熔点/℃
271
801
沸点/℃
1412
水溶液的酸碱性
碱性
中性
方案
实验步骤
预期的实验现象和结论
l
2
3
六、计算题(本题包括1个小题,共8分)
33.由于地球的二氧化碳剧增,由此产生的“温室效应”使自然灾害频繁发生,2004年底印度洋发生的大地震及海啸造成的惨剧使世人记忆犹新。消除“温室效应”的有效措施是广泛植树造林。已知
(1)需光照多长时间?
(2)若空气中含CO2质量分数为0.3%,需要标准状况下空气多少升?(标准状况下空气密度为
(3)若标准状况下氧气密度为