2006-2007学年度第二学期期中考试
八年级化学试题
注意:本次考试根据答题情况(字迹是否工整,卷面是否整洁,答题是否规范)设卷面分。卷面分最大值为5分,采用加分的办法按0、1、3、5四档计分。
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Cl:35.5 Ca:40
一、选择题:(40分)每小题有1~2个正确答案,将正确答案填入题后答题栏中。
1.推理是化学学习中常用的思维方法。以下4个推断正确的是
A.氧化物都含有氧元素,所以含有氧元素的化合物一定是氧化物
B.实验室制取氧气,必需使用含氧元素的化合物进行制取
C.物质与氧气反应有热量放出,且都伴随有火焰或光的现象产生
D.组成物质元素的化合价是定值,因此元素在同一物质中只有一种化合价
2.氧气是空气的主要成分之一,有关氧气说法错误的是
A.用带火星的木条可以检验氧气
B.用加热高锰酸钾的方法可以制取氧气
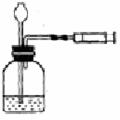
C.鱼类能在水中生活,证明氧气易溶于水
D.铁丝能在氧气中燃烧,火星四溅,产生黑色固体
3.高铁酸钾(K2FeO4)是一种具有氧化、吸附、凝聚、杀菌等功能的新型、高效水处理剂。它与水反应的化学方程式为:4K2FeO4+10H2O=4Fe(OH)3↓+8X+3O2↑,则X的化学式为
A.K2O B.KOH C.K D.KH
4.空气质量日报是环境监测部门对一个地区空气质量情况所做的监测报告。目前计入空气主要污染物的是可吸入颗粒物、一氧化碳、二氧化碳、二氧化硫、氮的氧化物。下列情况能直接造成空气污染的是
A.把煤作为主要燃料 B.随意丢弃塑料垃圾、废旧电池
C.大量使用化学肥料 D.利用太阳能、风能、等清洁能源
5.每年春天,我国北方都发生强烈的沙尘暴,大量沙尘不仅降落到北京,甚至远降韩国,日本也能观察到沙尘。专家对沙尘褒贬不一,有专家研究表明,沙尘能减弱酸雨的酸性,减弱温室效应,也有专家研究表明,沙尘是形成酸雨的原因之一。根据上述短文和你所学的知识判断,下列关于“沙尘”的说法中有错误的是
A.沙尘已成为跨国的环境问题
B.飘浮在空气中的沙尘属于空气质量周报时“首要污染物”中的可吸入颗粒物
C.沙尘形成酸雨,可能是沙尘吸收了经过地区被污染空气中的氮、硫氧化物所致
D.沙尘都可用来改良酸性土壤
6.根据所学化学知识,判断下列说法中正确的是
A.加碘盐中的“碘”通常是指碘单质 B.空气是由几种单质组成的混合物
C.催化剂在化学反应中都能加快物质的化学反应速率
D.物质发生化学反应时都遵循质量守恒定律
7.检验某可燃烧的化合物是否含有氢、碳、氧3种元素,在该物质完全燃烧后还必须进行的实验是:①用带火星的木条检验;②用无水硫酸铜检验;③用澄清石灰水检验;④对反应物、生成物进行称量。以下选项中正确的是
A.①②③④ B.②③④ C.①②③ D.②③
8.从安全、环保、节能、简便等方面考虑,实验室制取氧气的最佳方法是
 A.通电分解水:2H2O 2H2↑
+ O2↑
A.通电分解水:2H2O 2H2↑
+ O2↑
 B.过氧化氢催化分解:2H2O2(溶液) 2H2O+O2↑
B.过氧化氢催化分解:2H2O2(溶液) 2H2O+O2↑
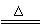
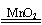 C.氯酸钾受热分解:2KClO3 2KCl+3O2↑
C.氯酸钾受热分解:2KClO3 2KCl+3O2↑
 D.高锰酸钾受热分解:2KMnO4 K2MnO4
+ MnO2 + O2↑
D.高锰酸钾受热分解:2KMnO4 K2MnO4
+ MnO2 + O2↑
9.关于一氧化碳在空气中燃烧 2CO+O2 2CO2的说法正确的是
A.反应过程中吸收大量的热
B.反应前后分子个数改变
C.参加反应的一氧化碳和氧气的质量比为2:l
D.化学方程式中反应物的化学计量数之比表示为ν (CO):ν (O2) =2:1
10.下列化学方程式符合题意且书写正确的是
 A.细铁丝在氧气中燃烧 4Fe+3O2 2Fe2O3
A.细铁丝在氧气中燃烧 4Fe+3O2 2Fe2O3
B.盐酸滴到铁器上 Fe+2HCl=== FeCl2+H2↑
C.胃酸过多的病人服用小苏打 NaHCO3+HCl=== NaCl+CO2↑+H2O
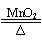 D.氯酸钾和二氧化锰混合加热 2KClO3 2KCl+O2↑
D.氯酸钾和二氧化锰混合加热 2KClO3 2KCl+O2↑
11.下列关于化学反应"X2十3Y2=2Z”的叙述错误的是
A.Z的化学式为XY3
B.若mg X2和ngY2恰好完全反应,则生成(m+n)g Z
C.若X2和Y2的相对分子质量分别为M和N,则Z的相对分子质量为(M+N)
D.若ag X2完全反应生成bg Z,则同时消耗(a一b)g Y2
12.甲、乙、丙、丁是初中化学中常见的四种物质,它们有如下转化关系:
①甲+丁→H2O ②乙+丁→CO2 ③丙+丁→H2O+CO2。则丙可能为
 A.H2 B.CH4 C.C2H5OH D.CO
A.H2 B.CH4 C.C2H5OH D.CO
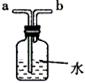
13.用推拉注射器活塞的方法可以检查右图装置的气密性。当缓慢拉动活塞时,如果装置气密性良好,则能观察到
A.注射器内有液体
B.瓶中液面明显上升
C.长颈漏斗内液面上升
D.长颈漏斗下端管口产生气泡
14.新研制的以农作物秸秆为原料的一次性餐盒,废弃后在自然条件下两个月就可以分解。下列关于此餐盒的有关说法不正确的是
A.代替塑料餐盒可减少“白色污染”
B.可有效利用秸秆,减少燃烧秸秆产生的空气污染
C.农作物秸秆属于化合物
D.这种餐盒是绿色环保产品
15在医院里给病人输氧时,常使用右下图所示装置。在装置中盛放大约半瓶蒸馏水,以下几种说法不正确的是
 A.b导管连在供氧气的钢瓶上
A.b导管连在供氧气的钢瓶上
B.b导管连在病人吸氧气的塑胶管上
C.该装置可用来观察是否有氧气输出
D.该装置可用来观察输出氧气的速率
16.NO是大气污染物,但少量NO在人体内具有扩张血管、增强记忆的功能。实验室收集NO只能用排水集气法。对NO的猜想或评价正确的是
A.易溶于水 B.可能极易与氧气反应
C.易与水反应 D.有害无利
17.锂电池是新型的高能电池,以质量轻、电容量大,颇受手机、手提电脑等用户的青睐。某种锂电池的总反应可表示Li + MnO2 = Li MnO2 。以下说法正确的是
①该反应中Mn的化合价发生了变化②该反应属于化合反应③Li MnO2为新型的氧化物 ④Li MnO2为锂、锰、氧的合金
A.①② B.①③ C. ②③ D.③④
18.硅酸盐矿泉水具有软化血管的作用,对心脏病、高血压等疾病患者有良好的医疗保健作用.硅酸钠的化学式为Na2SiO3,其中硅元素的化合价为
 A.+1 B. +2 C. +3 D. +4
A.+1 B. +2 C. +3 D. +4
19.已知碳酸氢钠不稳定,受热易分解2NaHCO3 Na2CO3 +CO2↑+H2O。 现取Na2CO3和NaHCO3的混合物10 g,加热到质量不再改变为止,剩余固体质量为6.9 g。下列说法正确的是
A.反应后生成CO2的质量为3.1g
B.反应后生成CO2和H2O的质量比为22∶9
C.原混合物中NaHCO3的质量为4.2g
D.原混合物中Na2CO3的质量分数为16%
20.2005年3月,国家质检局查出一些辣椒酱、番茄酱等食品中含有工业染色剂“苏丹红一号”,人食用后可能致癌。“苏丹红一号”的化学式为C16H12N2O 。下列有关“苏丹红一号”的说法中正确的是
A.“苏丹红一号”属于氧化物
B.“苏丹红一号”由30个原子构成
C.“苏丹红一号”的相对分子质量为248
D.“苏丹红一号”由四种元素组成
二、理解与应用(27分)
21.(4分)完成下列化学反应方程式并标出带“?”元素的化合价。
+1 +2 -2 +2 -2
H2O2 + BaSO3 = BaSO4↓+
气体
吸入气体
呼出气体
X
78.25%
74.88%
Y
21.05%
15.26%
CO2
0. 04%
3.68%
H2O
0. 66 %
6.18%
22.(4分)右表是小华对自己吸入的气体和呼出的气体进行探究的结果(体积分数)
⑴请你判断:X是_____,Y是____。(填化学式)
⑵请你回答:因参与新陈代谢而被人体消耗的是_____。
⑶请你分析:X气体在呼吸过程中没有参与化学反应,但呼出气体中体积分数却减少了,原因是:___________________________________________ ____________________________________________。
23.(6分)人类发明并使用氟里昂(主要用作致冷剂)若干年后,科学家发现氟里昂在紫外线的照射下能分解出氯原子破坏臭氧层,其破坏臭氧的循环示意图如下:
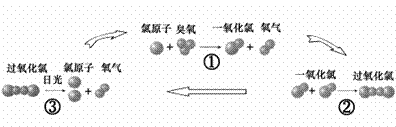 |
⑴请写出臭氧的化学式_______;
⑵上述反应属于化合反应的是(填序号)__________;
⑶经过上述①②③的反应过程后,反应物氯原子的个数是否发生变化?______(答:是或否)。
⑷诺贝尔奖金获得者莫里纳博士指出:“少量的氟里昂就能对臭氧层产生巨大的影响”,请你根据循环示意图论证他的观点
。
⑸在科学家的建议下,许多国家签署了停止使用和消费氟里昂的协议,使得大气中氟里昂的含量得到了控制。请你根据本题提供的信息就怎样有效保护我们的环境谈一点建议或认识:_____________________________________________________。
24.(6分)甲、乙、丙是三个实验的示意图,根据图中所发生的化学反应现象及化学反应原理,进行总结归纳并回答下列问题:
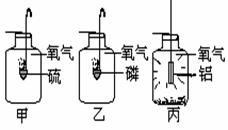 ⑴所发生的三个反应有多
⑴所发生的三个反应有多
个共同的特点,分别是?
① ;
② ;
③ ;
④
⑵甲实验进行时,燃烧匙中硫的状态是 。
 ⑶任选上述三个实验中的一个,写出反应的化学方程式:
。
⑶任选上述三个实验中的一个,写出反应的化学方程式:
。
25.(7分)右图是费俊龙和聂海胜在“神舟”六号飞船中的照片,请你从化学的视角对神六飞船的有关信息进行思考并作答。
⑴航天员在太空中每人每天大约需要0.9kg氧气、2.5 L水、0.6 kg食物,排出1.0 kg二氧化碳、1.8kg水蒸气等。上述的物质中,属于单质的是____________,属于化合物的是
___________,属于混合物的是___________。
⑵为了处理人体排出的CO2,飞船上采用了与氢氧化钠化学性质相似的氢氧化锂(LiOH)作为吸收剂。LiOH中锂元素的化合价是______。
⑶随着原始大气中O2缓慢地增加,CH4、NH3、CO等气体逐渐被氧化而缓慢地减少,使大气的成分逐渐演化成现代大气。原始大气中NH3可转化为现代大气中的 。
⑷在神六飞船中有篮球大小的储氧瓶6个,储氮瓶2个,它们是航天员的生命之源。舱内空气一天一换。宇航员说:“舱内的空气比地面还好。”请你设计:怎样使得舱内气体成分大致和地面保持一致?
三、实验与探究(21分)
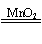 26.(6分)用双氧水和二氧化锰制氧气的反应方程式为:2H2O2 2H2O + O2 ↑。某同学做了该实验后,展开了下列思考与探究:
26.(6分)用双氧水和二氧化锰制氧气的反应方程式为:2H2O2 2H2O + O2 ↑。某同学做了该实验后,展开了下列思考与探究:
⑴催化剂MnO2的用量对反应速率有没有影响呢?
他做了这样一组实验:每次均用30mL10%的H202溶液,采用不同量MnO2粉末做催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
实验次序
1
2
3
4
5
6
7
8
9
10
MnO2粉末用量(克)
0.1
0.2
0.3
0.4
0.5
0.6
0.7
0.8
0.9
1.0
所用时间(秒)
17
8
7
5
4
3
2
2
2
2
请分析表中数据回答:MnO2的用量对反应速率有没有影响呢?如果有,是怎样影响的呢?
。
⑵H2O2溶液的溶质质量分数对反应速率有没有影响呢?
他又做了一组实验:每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验。记录数据如下:(实验均在20℃室温下进行,其他实验条件也均相同)
实验次序
1
2
3
4
5
6
7
8
H2O2溶液溶质质量分数
1%
3%
5%
10%
15%
20%
25%
30%
MnO2粉末用量(克)
0.2
0.2
0.2
0.2
0.2
0.2
0.2
0.2
收集到540mL气体时所用时间(秒)
660
220
205
80
25
9
4
3
反应后液体温度(℃)
24
34
39
56
65
67
69
70
请分析表中数据回答:H2O2溶液的溶质质量分数对反应速率有没有影响呢?如果有,是怎样影响的呢?
。
由表中数据还可看出,该反应是个 反应(填“放热”或“吸热”)。
⑶还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想: 。
27.(8分)下表列出了空气、氧气、二氧化碳、氨气在标准状况下的密度和溶解性。
物质
空气
氧气
二氧化碳
氨气
密度(g/L)
1.293
1.429
1.977
0.771
溶解性
/
不易溶
 能溶
能溶
极易溶
已知实验室可用下列反应制取氨气:2NH4C1(固)+Ca(OH)2(固) CaCl2+2NH3↑+2H2O。
⑴根据上述信息,选择实验室制取和收集氧气、氨气的装置,请在相关空格处√。



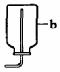
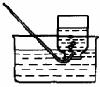
氧气
氨气
⑵写出图中有标号仪器的名称:a ;b 。
28.(7分)小明参观某养鱼池时,好奇的发现农民向养鱼池中撒一种叫过氧化钙的淡黄色固体,用来增加鱼池中的含氧量。小明刚学完氧气的实验室制法,于是他想可否用过氧化钙来制取氧气。
[提出问题]过氧化钙可否用于制取氧气?
[查阅资料]部分内容如下:过氧化钙(CaO2)室温下稳定,在300℃时分解生成氧气,可作增氧剂、杀菌剂等。
[猜想与验证]
⑴小明依据 ,提出猜想Ⅰ。
猜想Ⅰ:加热过氧化钙可制取氧气。
实验装置
实验主要过程
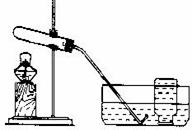
①检查装置气密性。操作如下:先将导管伸入液面下,用手紧握试管,观察到 ,松开手后,有液体进入导管。
②加入过氧化钙,加热,导管口有大量气泡昌出。
③收集满一瓶气体。
④停止加热。熄灭酒精灯前,应
。
⑤检验气体,方法是
。
实验结论:加热过氧化钙可制取氧气。
⑵分析与反思:
①虽然没有快速收集到大量氧气,由此实验现象,小明认为农民用过氧化钙作增氧剂的主要原因是 。
②小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?
你的合理建议是 。
以上建议是否可行,还需进一步通过实验验证。
 四、计算(12分)
四、计算(12分)
31、(4分)实验室有一瓶未开封的浓盐酸,部分标签如右图所
示。这瓶浓盐酸中溶液的质量为 g.若用这瓶浓盐
酸来配制200g溶质质量分数为10%的稀盐酸,需量取浓盐酸
的体积是 mL,水的体积是 mL。
32、(8分)家里蒸馒头用的纯碱中含有少量的氯化钠,课外探究小组的同学欲测定纯碱中碳酸钠的含量。他们取该纯碱样品11.0g,全部溶解在100.0g水中,再加入氯化钙溶液141.0g,恰好完全反应,化学反应方程式为:Na2CO3+CaCl2=2NaCl+CaCO3↓过滤干燥后,称得沉淀质量为10.0g。请计算:
⑴纯碱样品中碳酸钠的质量;
⑵反应后所得滤液中溶质的质量分数。