2006年中考化学模拟考试(二)
可能用到的相对原子质量:H--1 C--12 O--16 Na--23 Al--27 S--32
C1―35.5 K--39 Ba--137
一、选择题(每一小题只有一个选项是符合题意)
1.下列变化属于物理变化的是( )
A.石油燃烧 B.铁钉生锈 C.冰融化成水 D.加热碱式碳酸铜固体
2.在下列各组物质中,前者为单质,后者为混合物的是( )
A.铝、碱式碳酸铜 B.生石灰、食盐水
C.水银、洁净的空气 D.硫粉、含氮35%的硝酸铵
3.下列有关原子的说法中错误的是( )
A.原子的质量和体积都很小 B.原子总是不断地运动
C.原子可以构成分子 D.原子最小,不可以再分
4.某物质经分析含有一种元素,则该物质( )
A.一定是混合物 B.一定是纯净物
C.可能是化合物 D.可能是纯净物也可能是混合物
5.人们认为氢气是未来的理想燃料,其理由是( )
A.氢气燃烧产生大量热,生成物不污染环境 B.工业上很容易制取氢气
C.空气中含有大量氢气 D.海水中含有大量氢气
6.下列原子中,容易失去电子变成阳离子的是( )
A.第一层有2个电子的原子 B.最外层有1个电子的原子
C.最外层有4个电子的原子 D.最外层有8个电子的原子
7.波尔多液中含有氢氧化钙和硫酸铜,不能用铁桶盛放的主要原因是( )
A.铁会与硫酸铜溶液发生置换反应 B.铁会与氢氧化钙发生置换反应
C.波尔多液含有水分,使铁桶容易锈蚀
D.铁桶难密封,氢氧化钙易与空气中的二氧化碳反应而发生变质
8.对铁粉投入足量的盐酸溶液中的反应描述错误的是( )
A.溶液的pH值升高 B.溶液中有气泡放出
C.铁粉逐渐溶解 D.生成了氯化铁溶液
9.商店里出售的橡胶运动鞋,鞋底有黑、白两种,黑色橡胶鞋底耐磨,这是因为在橡胶中加入一种耐磨的填料,这种耐磨的填料是( )
A.石墨粉 B.活性炭 C.木炭粉 D.炭黑
10.只用一种试剂,一次就能区别硫酸钠、硝酸银和碳酸钠三种溶液,这种试剂是( )
A.氯化钡 B.盐酸 C.稀硝酸 D.氢氧化钾溶液
11.20℃时,下列四种物质的溶解度最大的是( )
A.1gA物质溶解在10g水中达饱和
B.15gB物质溶解在300g水中制成饱和溶液
C.10gC物质溶解在50g水中达饱和
D.74gD物质溶解在1000g水中制成饱和溶液
12.下列各组物质能在水溶液中大量共存的是( )
A.硝酸钡、碳酸钾、硝酸 B.硫酸铁、氯化铜、氢氧化钠
C.氯化钾、硝酸钡、硫酸镁 D.氯化钾、硝酸钡、硝酸钠
13.氢氧化钙在80℃时的溶解度为x克,20℃时的溶解度为y克。取20℃时的氢氧化钙饱和溶液,蒸发掉w克水后再恢复到20℃,这时溶液的溶质质量分数为z%.则下列关系正确的是( ).
A.x > y > z B.y > x;y > z C.y < x;y < z D.x < y < z
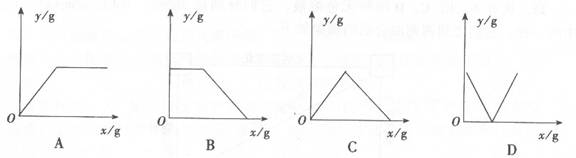
14.向一定量的Na2CO3溶液中逐渐滴加Ba(OH)2溶液直至过量,能正确表示生成BaC03沉淀的质量y(纵轴)与所加Ba(OH)2的质量x(横轴)关系的图象是( )
二.填空题
15.明矾的化学式是KAl(S04)2?12H20,其相对分子质量为 ,其中钾、铝、硫、氢、氧元素的质量比是 ,结晶水的质量分数为 。
16.写出下列粒子中“3”的涵义。 +3
3K+ ,O3(臭氧) ,Al3+ ,Fe 。
17.实验室用铁、氧化铜、硫酸为原料制取铜,某同学设计了两个实验方案:
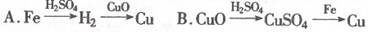
两个实验方案中最好的是 ,理由是 。
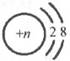 18.右图是粒子的结构示意图,用化学符号表示下列粒子:
18.右图是粒子的结构示意图,用化学符号表示下列粒子:
(1)当n=10时是 ;(2)当n=9时是 ;
(3)当n=11时是 。
19.根据右图回答:(1)50℃时氯化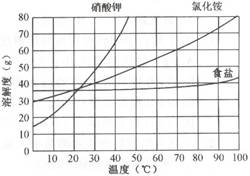 铵的溶解 度 g。此温度下氧化铵的饱和溶液的溶质质量分数 %。(2)三种物质的溶解度,随温度变化最大的是 ,随温度变化最小的是
。
铵的溶解 度 g。此温度下氧化铵的饱和溶液的溶质质量分数 %。(2)三种物质的溶解度,随温度变化最大的是 ,随温度变化最小的是
。
三、
20.硫酸最古老的生产方法是:把绿矾 (FeS04?7H20)装入反应器中加强热,会流出油状液体,并放出有刺激性气味的气体(S02),反应器中的固体变为红色。这个变化的过程可用两个化学方程式表示,写出两个化学方程式,并指出反应类型.
化学方程式 反应基本类型
①
②
 21.现有A,B,C,D四种五色溶液,它们 分别是MgS04、BaCl2、Na2C03、H2S04中的一种.它们之间两两混合后的现象如右图所示:
21.现有A,B,C,D四种五色溶液,它们 分别是MgS04、BaCl2、Na2C03、H2S04中的一种.它们之间两两混合后的现象如右图所示:
试判断A、B、C、D各为什么溶液:
A ,B ,
C ,D 。
四、
22.双氧水常用于消毒、漂白等方面,它是含过氧化氢(H202)的溶液。含H202 30%的水溶液以Mn02作催化剂时,可迅速分解出氧气: 2H202=2H20+02↑
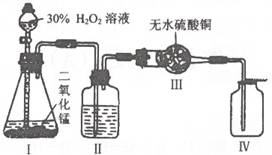
现欲制得干燥纯净的氧气,可采用上图实验装置。
(1)Ⅱ瓶中装的物质(液体)是 。
(2)在制取过程中怎样除掉I,Ⅱ,Ⅲ,Ⅳ装置中的空气?
(3)怎样知道瓶Ⅳ中收集的氧气是干燥氧气?
(4)怎样知道瓶Ⅳ中氧气已装满?
23.从下图中选择部分仪器组装成制取干燥、纯净氢气的装置.
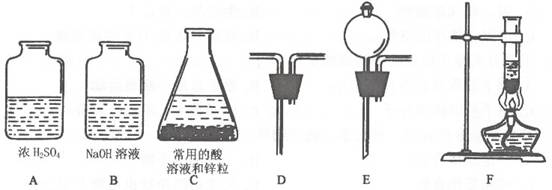
(1)制取氢气的发生装置应选用(填序号) 和 组装。
(2)将氢气中可能存在的杂质气体和水蒸气除去,应将混合气体依次通过____由_____ 和 、 和 组装成系列装置.
(3)若实验结果,A,B中物质质量都有所增大,则说明:①生成的氢气中含有 杂质;②制氢气时所用的可能是 酸;③用浓硫酸可以除去水蒸气是因为浓硫酸具有 性。
五、计算题
24.在20℃时,向174.4g硫酸钾饱和溶液,加入溶质质量分数为20%的氯化钡溶液104g,恰好完全反应。计算硫酸钾饱和溶液中溶质和溶剂的质量。
25.密度为1.1g/ml的盐酸溶液33.2ml,在20℃时跟60g的碳酸钠溶液恰好完全反应,反应后溶液的总质量为92.12g.求:反应后的溶液的溶质质量分数。