2009届湖南省长沙市一中高三第五次月考试卷化学
时量:90分钟 满分:108分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Mg-24 Al-27 Fe-56 Ba-137
一、选择题(每小题2.5分,共50分,每小题均只有一个选项符合题意)
1. 下列电离方程式,书写不正确的是
A.NaHSO4===Na++H++SO42- B.HF+H2O H3O++F-
H3O++F-
C.NaHS===Na++HS- D.HCO3-+H2O H2CO3+OH-
H2CO3+OH-
2.下列粒子中,能破坏水的电离平衡且能使水的电离平衡向正方向移动的是
A. CH3COOH B. OH- C. HSO4- D. S2-
3.某种胶体在电泳时,它的粒子向阴极运动,在这种胶体中分别加入下列物质:①蔗糖溶液 ②硫酸镁溶液 ③硅酸胶体 ④氢氧化铁胶体,不会发生凝聚的是
A.①③ B.①④ C. ②③ D.③④
4.常温下,向pH=2的H2SO4中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是
A.pH=12的Ba(OH)2 溶液 B.pH=12的氨水
C.0.05mol/L的NaOH溶液 D.0.05mol/L的BaCl2溶液
5.下列溶液,一定呈酸性的是
A.pH=6的溶液 B.c(H+)=2×10-7mo/L的溶液
C.加甲基橙显红色的溶液 D.加酚酞不显色的溶液
6.室温下,将x mLpH=a的稀NaOH溶液与y mLpH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是
A.若x=y,且a+b=14,则pH>7 B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7 D.若x=10y,且a+b=14,则pH>7
7.下列各组离子,在溶液中可以大量共存的离子组是
A.Al3+、Na+、NO3-、S2- B.AlO2-、Na+、Cl-、CO32-
C.K+、SCN-、NO3-、Fe3+ D.Ba2+、HCO3-、Cl-、OH-
8.向NaAlO2溶液中持续通入一种气体,开始产生沉淀,随后沉淀又逐渐溶解,该气体是
A.NO2 B.CO
9.向某无色溶液中加入含Fe2+的溶液后,无明显变化,当滴入几滴新制氯水后,混合液变成血红色,则下列结论错误的是
A.该溶液中一定含有SCN- B.氧化性:Fe3+>Cl2
C.Fe2+与SCN-不能形成红色物质 D.Fe2+被氯水氧化为Fe3+
10.下列反应的离子方程式书写正确的是
A.Fe2O3溶于过量的氢碘酸中:www.ks5 u.comFe2O3+6H+===2Fe3++3H2O
B.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32-
C.向Fe(NO3)2溶液中加稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
D.Cu片加入FeCl3溶液中:Fe3++Cu===Fe2++Cu2+
11.某溶液所含溶质是NaOH、Na2CO3、NaHCO3中的一种或两种。取两份等体积的该溶液,分别用酚酞和甲基橙作指示剂,用同浓度的盐酸滴定,当达到滴定终点时消耗盐酸的体积分别为V1和V2,若V1<V2<2V1,则上述溶液中的溶质是
A.Na2CO3
B.NaHCO
12. 某二元弱酸的酸式盐NaHA溶液,若pH<7,则溶液中各粒子的浓度关系不正确的是
A.c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) B.c(Na+)+
c(H+)= c(HA-)+
C.c(H+)+
c(A2-)= c(OH-)+ c(H
13.已知NaHSO4在水中的电离方程式为:NaHSO4===Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,对于该溶液,下列叙述不正确的是
A.该温度高于
B.水电离出来的c(H+)=1.0×10-10mol/L
C.c(H+)=c(OH-)+c(SO42-)
D.该温度下加入等体积pH为12的NaOH溶液, 反应后的溶液恰好呈中性
14.常温下,甲、乙两杯醋酸的稀溶液,甲的pH=2,乙的pH=3,对下列叙述的判断不正确的是
A.甲中水电离出的H+的物质的量浓度是乙中水电离出的H+的物质的量浓度的1/10
B.物质的量浓度c(CH3COOH)甲>
C.中和等量的NaOH溶液需甲、乙两杯醋酸溶液的体积:10V(CH3COOH)甲>V(CH3COOH)乙
D.甲中的c(OH-)为乙中c(OH-)的1/10
15.把铝粉和氧化亚铁配成铝热剂,分成两等份,一份在高温下恰好完全反应后,再与足量盐酸反应,另一份直接放入足量的烧碱溶液中充分反应;前后两种情况下生成的气体质量之比是
A.1┱1 B.2┱
16.下列实验中产生的现象与对应图形(纵坐标n均表示产生的Al(OH)3的物质的量)不相符的是
A.在AlCl3溶液中滴加氨水至过量 B.向NaOH溶液中滴加AlCl3至过量




C.向NaAlO2溶液中滴加盐酸至过量 D.向H2SO4溶液中加入NaAlO2溶液至过量
 |
|||
 |
|||
17.在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c, 则下列判断不正确的是
A.最后得到的溶液中不含Fe3+ B.残余固体可能为铁、铜混合物
C.最后得到的溶液中只含Cu2+ D.残余固体可能全部是铜
18.有镁、铝混合粉末
A.1500mL B.1000mL C.500mL D.100mL
19.现有2mol/L盐酸和硫酸溶液各100mL,分别加入等量的铁粉,反应结束后,所生成的氢气质量比为2┱3,则往酸中加入的铁粉的质量为
A.
20.NaH是一种离子化合物,跟水反应的化学方程式为:NaH+H2O=NaOH+H2↑,现有a molNaH与b mol Al粉混合物跟足量的水反应(a<b),在标准状况下可收集到氢气的量为
A. C.
C. D.56b L
D.56b L
二、填空题(每空2分,共28分)
21.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水而氢氧化锌能溶于氨水生成[Zn(NH3)4]2+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为 (用化学式表示);
(2)写出锌跟氢氧化钠溶液反应的离子方程式 ;
(3)下列各组中的两种溶液,用相互滴加的方法即可鉴别的是
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氨水 ④偏铝酸钠和盐酸 ⑤碳酸氢钠和氢氧化钙
22.(1)在饱和氯化铁溶液中加入碳酸钙粉末,发现沉淀逐渐转变为红褐色,并产生无色气体。用离子方程式表示产生上述现象的原因 。
(2)在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是
A.磷 B.硫 C.镁 D.铜
(3)在Fe(OH)3胶体中,逐滴加入HI稀溶液。出现的现象是:先产生红褐色沉淀,其原因是 ,随后沉淀溶解,其离子方程式是 。
(4)向物质的量之和为0.1mol的FeCl3和AlCl3混合溶液中加入90mL4mol/L的NaOH溶液,使其充分反应。假设原溶液中Al3+的物质的量与Al3+和Fe3+的总物质的量之比为X。
①当X=0.4时,溶液中产生的沉淀是 ,其物质的量为 。
②当沉淀只有Fe(OH)3时,X的取值范围为 。
23.有A、B、C、D、E、F六种原子序数依次增大的主族元素,其相关信息如下:
①短周期元素C原子的最外层有4个电子,E单质可在空气中燃烧;
②右表是元素周期表中的主族元素的一部分:
C
D
E
F
③A、B为同周期相邻金属元素,A原子最外层电子数是其电子总数的1/6;
据些回答下列问题:
(1)D的元素符号是 ,F在元素周期表中的位置为 ;
(2)C的最高价氧化物与烧碱溶液反应的离子方程式为 ;
(3)B、E两元素分别形成的简单离子在水溶液中发生反应的离子方程式为 。
三、实验题(每空2分,共20分)
24.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1)配平离子方程式: MnO4-+ HSO3-+ H+―― Mn2++ SO42-+ H2O
(2)滴定过程中,NaHSO3溶液的体积是20.00mL,消耗0.100mol/L的酸性KMnO4溶液16.00mL,则NaHSO3溶液的物质的量浓度是 mol/L。
(3)下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视
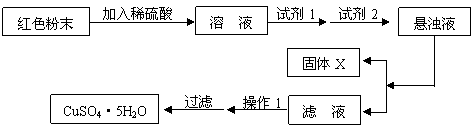
25.已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4。三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某化学兴趣小组通过实验来探究某红色粉末是Fe2O3或Cu2O或两者的混合物。(实验所需试剂只能从下列中选择:稀硫酸、KSCN溶液、稀硝酸、双氧水、铁粉、碱式碳酸铜)
探究方案:将红色粉末溶于足量的稀硫酸中;实验现象:反应后有红色固体存在;
(1)结论:红色粉末是 。
(2)如果红色粉末是Fe2O3和Cu2O的混合物,请设计实验证明之。
实验方法:
实验现象:
(3)兴趣小组欲利用Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4?5H2O)。经查阅资料得知:在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
物质
Cu(OH)2
Fe(OH)2
Fe(OH)3
开始沉淀的pH
6.0
7.5
1.4
沉淀完全的pH
13
14
3.7
实验小组设计如下实验方案:
 |
试回答:
①试剂1为 ,试剂2为 (填名称);
②固体X的化学式为 ;
③操作1为 。
四、计算题(10分)
26.某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式。
 |
(3)假设实验过程中向该溶液中加入的NaOH溶液的物质
的量浓度为5mol/L,请画图表示生成沉淀的物质的量与加入
NaOH溶液的的体积关系。
一、选择题(每小题2.5分,共50分)
题号
1
2
3
4
5
6
7
8
9
10
答案
D
D
B
D
C
D
B
A
B
C
题号
11
12
13
14
15
16
17
18
19
20
答案
C
C
D
C
A
D
C
B
C
A
二、填空题(每空2分,共28分)
21、(1)AlO2-;(2)Zn+2OH-=ZnO22-+H2↑ (3)①③④
22、(1)Fe3++3H2O Fe(OH)3+3H+ CaCO3+2H+===Ca2++CO2↑+H2O
Fe(OH)3+3H+ CaCO3+2H+===Ca2++CO2↑+H2O
(2)C
(3)HI是强电解质,使胶体聚沉;2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O
(4)①Fe(OH)3, 0.06mol;②0<X≤0.6
23.(1)P,第四周期第ⅥA族;
(2)SiO2+2OH-===SiO32-+H2O;
(3)2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑
三、实验题(每空2分,共20分)
24.(1)2、5、1、2、5、3 (2)0.2000;(3)ACD
25.(1)Cu2O或Fe2O3和Cu2O的混合物;
(2)取少许红色粉末溶于足量稀硫酸中,充分溶解后滴加KSCN溶液,再滴加双氧水;
有红色固体生成,加KSCN溶液不显红色,再加双氧水后显红色。
(3)①双氧水、碱式碳酸铜;②Fe(OH)3;③蒸发、浓缩、冷却、结晶。
四、计算题(10分)
26.(1)NH4+、Al3+、SO42-( (3分)
(2)NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O] (4分)
 (3)
(3)
(3分)