2008-2009学年度上期期末成都市调研考试高一化学
考试时间:120分钟 全卷满分:150分
A卷 (共100分)
可能用到的相对原子质量:H―1 He―4 C―12 N―14 O―16 Na―23 S―32 Cl―35.5 K―39 Ca―40 I―127
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1、“化学,是人类进步的关键”,学习和研究化学是为了更好的认识世界,下列涉及的内容一般不属于化学研究范围的是
A.研究一种新材料的性质和用途 B.研究一种新物质的运动规律
C.研究一种新药品的合成 D.研究一种新微粒的组成和结构
2、下列关于强电解质、弱电解质、非电解质的归类中,完全正确的一组是
强电解质
弱电解质
非电解质
A
H2SO4
CH3COOH
Cu
B
Ca(OH)2
BaSO4
CO2
C
NaHCO3
Fe(OH)3
H2O
D
CaCO3
NH3?H2O
C2H5OH(酒精)
3、下列叙述中正确的是
A.需加热的反应都是吸热反应 B.放热反应不需要加热或点燃条件
C.Ba(OH)2?8H2O与NH4Cl的反应是放热反应 D.化学反应中的能量可以在不同条件下转化为热能、电能等
4、下列叙述中正确的是
A.卤素离子(X―)只有还原性而无氧化性 B.某元素由化合态变成游离态,该元素一定被氧化
C.硫酸的摩尔质量是98 D.常温下0.1molH2 的体积是 2.24L
5、下列物质中,在标准状况下体积最大的是
A.1000gH2O B.71gCl2 C.48g O2 D.8g H2
6、下列关系正确的是
A.离子半径:Na+>K+ B.还原性:Na>K C.溶解度:I2在CCl4中>I2在H2O中 D.熔点:Na<K
7、下列关于卤素及其化合物的叙述中正确的是
A.从F2到I2熔沸点逐渐降低 B.从HF到HI还原性逐渐增强
C.从F2到I2氧化性逐渐增强 D.从HF到HI热稳定性逐渐增强
8、下列有关实验现象的描述错误的是
A.点燃的氢气在氯气中安静地燃烧,发出苍白色火焰 B.红热的铜丝在氯气中剧烈燃烧,产生棕黄色烟
C.钠与硫酸铜溶液反应有红色物质析出 D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
|

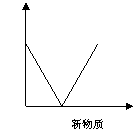 A.澄清石灰水中通入CO2至过量
A.澄清石灰水中通入CO2至过量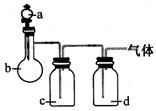 ①定容时俯视刻度线 ②定容时仰视刻度线 ③所用容量瓶事先用NaOH溶液润洗 ④称量NaOH时,称量时间太长 ⑤摇匀后,将所配溶液装入用蒸馏水洗净、未干燥的试剂瓶
①定容时俯视刻度线 ②定容时仰视刻度线 ③所用容量瓶事先用NaOH溶液润洗 ④称量NaOH时,称量时间太长 ⑤摇匀后,将所配溶液装入用蒸馏水洗净、未干燥的试剂瓶

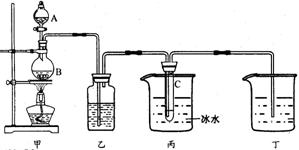 35、(10分)某课外活动小组用如图所示装置制取次氯酸钠。仪器A中盛浓盐酸。
35、(10分)某课外活动小组用如图所示装置制取次氯酸钠。仪器A中盛浓盐酸。
