题目内容
 (2011?琼海一模)如图所示,左右两个容器的侧壁都是绝热的、底部都是导热的、横截面积均为S.左容器足够高,上端敞开,右容器上端由导热材料封闭.两个容器的下端由容积可忽略的细管连通.容器内两个绝热的活塞A、B下方封有氮气,B上方封有氢气.大气的压强为p0,外部气温为T0=273K保持不变,两个活塞因自身重力对下方气体产生的附加压强均为0.1p0.系统平衡时,各气体柱的高度如图所示.现将系统的底部浸入恒温热水槽中,再次平衡时A上升了一定的高度.用外力将A缓慢推回第一次平衡时的位置并固定,第三次达到平衡后,氢气柱高度为0.8h.氮气和氢气均可视为理想气体.求:
(2011?琼海一模)如图所示,左右两个容器的侧壁都是绝热的、底部都是导热的、横截面积均为S.左容器足够高,上端敞开,右容器上端由导热材料封闭.两个容器的下端由容积可忽略的细管连通.容器内两个绝热的活塞A、B下方封有氮气,B上方封有氢气.大气的压强为p0,外部气温为T0=273K保持不变,两个活塞因自身重力对下方气体产生的附加压强均为0.1p0.系统平衡时,各气体柱的高度如图所示.现将系统的底部浸入恒温热水槽中,再次平衡时A上升了一定的高度.用外力将A缓慢推回第一次平衡时的位置并固定,第三次达到平衡后,氢气柱高度为0.8h.氮气和氢气均可视为理想气体.求:(1)第二次平衡时氮气的体积;
(2)水的温度.
分析:第一个过程是等温过程,应用玻意耳定理可解得,第二步为等压变化,用盖-吕萨克定理可以解得.
解答:解:(1)考虑氢气的等温过程,该过程的初态压强为P0,体积为hS,末态体积为0.8hS,
设末态的压强为P,由玻意耳定理得:
P=
=1.25P0
活塞A从最高点被第一次推回平衡位置的过程是等温过程,该过程的初态压强为1.1P0,体积为V,末态压强为P′,末态压强V′
则:P′=P+0.1P0=1.35P0
V′=2.2hS
由玻意耳定理得:V=
×2.2hS=2.7hS
(2)活塞A从从最初位置升到最高位置过程为等压过程,该过程的初态体积和温度分别为2hS和T0=273K,末态体积为2.7hS,
设末态温度为T,由该吕萨克定律得:T=
T0=368.55K
答:第二次平衡时氮气的体积为2.75hS;水的温度为368.55K.
设末态的压强为P,由玻意耳定理得:
P=
| P0hS |
| 0.8hS |
活塞A从最高点被第一次推回平衡位置的过程是等温过程,该过程的初态压强为1.1P0,体积为V,末态压强为P′,末态压强V′
则:P′=P+0.1P0=1.35P0
V′=2.2hS
由玻意耳定理得:V=
| 1.35P0 |
| 1.1P0 |
(2)活塞A从从最初位置升到最高位置过程为等压过程,该过程的初态体积和温度分别为2hS和T0=273K,末态体积为2.7hS,
设末态温度为T,由该吕萨克定律得:T=
| 2.7hS |
| 2hS |
答:第二次平衡时氮气的体积为2.75hS;水的温度为368.55K.
点评:解题的关键点是找准变化过程属于等温过程、等压过程、还是等容过程,然后列出相应的关系式.

练习册系列答案
相关题目
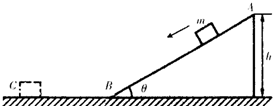 (2011?琼海一模)如图所示,抗震救灾运输机在某场地卸放物资时,通过倾角θ=30°的固定的光滑斜轨道面进行.有一件质量为m=2.0kg的小包装盒,由静止开始从斜轨道的顶端A滑至底端B,然后又在水平地面上滑行一段距离停下,若A点距离水平地面的高度h=5.0m,重力加速度g取10m/s2,求:
(2011?琼海一模)如图所示,抗震救灾运输机在某场地卸放物资时,通过倾角θ=30°的固定的光滑斜轨道面进行.有一件质量为m=2.0kg的小包装盒,由静止开始从斜轨道的顶端A滑至底端B,然后又在水平地面上滑行一段距离停下,若A点距离水平地面的高度h=5.0m,重力加速度g取10m/s2,求: (2011?琼海一模)如图,A、B是在地球大气层外圆周轨道上运行的质量不等的两颗卫星,它们的轨道半径满足RA=2R,RB=3R,R为地球半径,下列说法正确的是( )
(2011?琼海一模)如图,A、B是在地球大气层外圆周轨道上运行的质量不等的两颗卫星,它们的轨道半径满足RA=2R,RB=3R,R为地球半径,下列说法正确的是( ) (2011?琼海一模)M、N是一对水平放置的平行板电容器,将它与一电动势为E,内阻为r的电源组成如图所示的电路,R是并联在电容器上的滑动变阻器,G是灵敏电流计,在电容器的两极板间有一带电的油滴处于悬浮状态,如图所示,现保持开关S闭合,将滑动变阻器的滑片向上滑动,则( )
(2011?琼海一模)M、N是一对水平放置的平行板电容器,将它与一电动势为E,内阻为r的电源组成如图所示的电路,R是并联在电容器上的滑动变阻器,G是灵敏电流计,在电容器的两极板间有一带电的油滴处于悬浮状态,如图所示,现保持开关S闭合,将滑动变阻器的滑片向上滑动,则( )