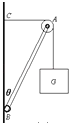
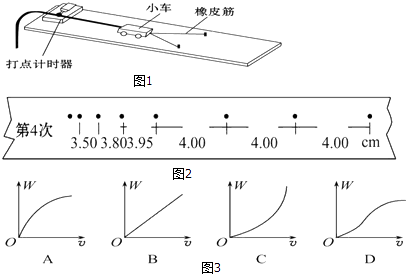
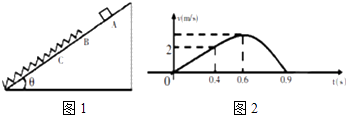
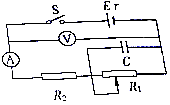
��Ŀ����
����Ŀ����ͼ��ʾ����ֱ���õ�ԲͲ��ע�����������϶˽�����ѹ�����ܹ���������������������ѹǿ����ʼʱ���������ھ�ֹ״̬����ʱ�������Ϊ30cm3 �� ��ѹ������Ϊ1.1��105Pa�������������ƶ�������ʹ�������������ƶ�һ�ξ��룬�ȶ�����ѹ������Ϊ2.2��105Pa�����ƻ����������ڱڼ��Ħ���������¶ȱ��ֲ��䣮
��1����Ҫ˵�������ƶ������У��������������������
��2��������ȶ�����������
��3���Ըù����е�ѹǿ�仯�����۽���
���𰸡�
��1��
���ƶ������Ĺ����У����������С����������������W��0�������¶Ȳ��䣬�������������ƶ������У������¶Ȳ��䣬�����¶����ܲ��䣬��U=0��������ѧ��һ���ɡ�U=W+Q����֪Q=��U��W=��W��0���������Ҫ�ų�������
��2��
���巢���˵��±仯���ɲ�������ɿɵã�P1V1=P2V2������1.1��105Pa��30cm3=2.2��105Pa��V2����ã�V2=15cm3��
��3��
�����¶Ȳ��䣬����ƽ�����ܲ��䣬ÿ�����Ӷ����ڵ�ײ�������䣻�ڻ��������ƶ��Ĺ����У����������С�������ܶ����ӣ���λʱ����ײ�����ڵķ��������ӣ����ڵ�λ����ܵ���ѹ����������ѹǿ����
�������������ƶ������Ĺ����У����������С����������������W��0��
�����¶Ȳ��䣬�������������ƶ������У������¶Ȳ��䣬�����¶����ܲ��䣬��U=0��
������ѧ��һ���ɡ�U=W+Q �� ��֪Q=��U��W=��W��0���������Ҫ�ų�������
�����巢���˵��±仯���ɲ�������ɿɵ���P1V1=P2V2 ��
����1.1��105Pa��30cm3=2.2��105Pa��V2 �� �����V2=15cm3 ��
�������¶Ȳ��䣬����ƽ�����ܲ��䣬ÿ�����Ӷ����ڵ�ײ�������䣻
�ڻ��������ƶ��Ĺ����У����������С�������ܶ����ӣ�
��λʱ����ײ�����ڵķ��������ӣ����ڵ�λ����ܵ���ѹ����������ѹǿ����
���Դ��ǣ��ٷ��������ȣ��ڻ����ȶ�������������15cm3��
�������¶Ȳ��䣬����ƽ�����ܲ��䣬���������С�������ܶ���������ѹǿ���

 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�