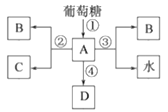
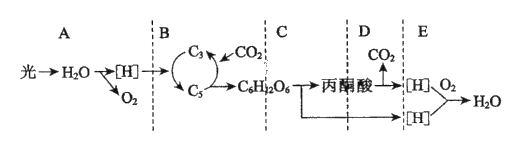
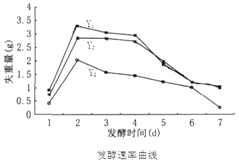
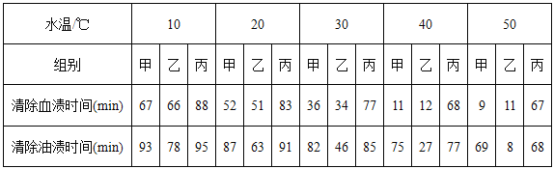
题目内容
【题目】如图是达到平衡的渗透装置,半透膜不允许蔗糖分子通过,此时漏斗内(S1)和漏斗外(S2)为两种不同浓度的蔗糖溶液,液面的高度差为 ![]() h,初始时漏斗内、外液面相平。下列说法正确的是( )
h,初始时漏斗内、外液面相平。下列说法正确的是( )

A. 初始时水分子从S1到S2的速率小于S2到S1的速率
B. 此时漏斗内外液体浓度大小关系为S1小于S2
C. 若向漏斗内加入蔗糖酶,则 ![]() h逐渐变大直至重新达到平衡
h逐渐变大直至重新达到平衡
D. 若漏斗内外是不同浓度的硝酸钾溶液,平衡时S1的浓度大于S2的浓度
【答案】A
【解析】
据图分析,渗透作用是指水分子通过半透膜,从溶质浓度低的溶液向溶质浓度高的溶液转移的现象;漏斗内液面上升,则漏斗内溶液(S1)浓度大于漏斗外溶液(S2),渗透平衡时的液面差为△h,此时的S1浓度仍然大于S2的浓度,是因为静水压抵消掉了浓度差,静水压使水分子向下运动的力,浓度差使水分子向上运动力,渗透平衡时这两个力平衡,因此,只要有高度差就会有浓度差存在。
漏斗内溶液(S1)和漏斗外溶液(S2)为两种不同浓度的蔗糖溶液,渗透平衡时液面差为△h,此时S1和S2浓度的大小关系为S1>S2,A正确;据图分析,渗透平衡时,漏斗内外液体浓度大小关系仍然为S1大于S2,B错误;若向漏斗内加入蔗糖酶,则S1溶液摩尔浓度增大,液面会上升,随着蔗糖分解成的单糖透过半透膜,液面开始下降,C错误;如果S1为KNO3溶液,则在水中电离成硝酸根离子和钾离子,而硝酸根离子和钾离子能够通过半透膜,最终半透膜两侧的溶液浓度相等,则一段时间后△h为零,D错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目