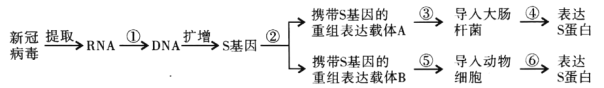
题目内容
【题目】某有机物的蒸气密度是相同状况下甲烷密度的5.75倍。把1.84g该有机物在氧气中充分燃烧,将生成的气体混合物通过足量的碱石灰,碱石灰增重4.08g。又知生成H2O和CO2的物质的量之比为![]() ,该有机物的分子式为___________________。
,该有机物的分子式为___________________。![]() 该有机物与足量的金属钠反应时,可以得到(标准状况)下氢气
该有机物与足量的金属钠反应时,可以得到(标准状况)下氢气![]() 。它的结构简式_________________。
。它的结构简式_________________。
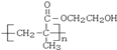
【答案】![]()
![]()
【解析】
该有机物相对分子质量为16×5.75=92,1.84g该有机物物质的量为![]() =0.02mol,有机物燃烧生成二氧化碳、水总质量为4.08g,且生成H2O和CO2的物质的量之比为4:3,设二者物质的量分别为4a mol、3a mol,则3a×44+4a×18=4.08,解得a=0.02,故水为0.08mol,二氧化碳为0.06mol,则有机物分子中C原子数目为3,H原子数目为8,则O原子数目为
=0.02mol,有机物燃烧生成二氧化碳、水总质量为4.08g,且生成H2O和CO2的物质的量之比为4:3,设二者物质的量分别为4a mol、3a mol,则3a×44+4a×18=4.08,解得a=0.02,故水为0.08mol,二氧化碳为0.06mol,则有机物分子中C原子数目为3,H原子数目为8,则O原子数目为![]() =3,故该有机物分子式为C3H8O3;
=3,故该有机物分子式为C3H8O3;
根据该物质的分子式C3H8O3可知该物质C原子均为饱和碳原子,所以不含羧基,所以与Na反应生成氢气的官能团为羟基,1mol该有机物与足量的金属钠反应生成的氢气物质的量为![]() =1.5mol,所以含有3个羟基,结构简式为
=1.5mol,所以含有3个羟基,结构简式为![]() 。
。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目