【题目】Ⅰ.(1)同学用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液测定计算中和反应的反应热。回答下列向题:
从实验装置上看,图中缺少的一种玻璃用品是_______。如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将___填“偏大”、“偏小”或“无影响”)。已知稀盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73kJ的热量,则表示该反应中和热的热化学方程式为________。
(2)乙同学用另一装置将V1 mL 1.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。回答下列问题:
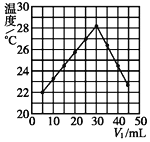
做该实验时,环境温度__(填“高于”、“低于”或“等于”)22℃。根据图计算该NaOH溶液的浓度约是__mol·L-1。
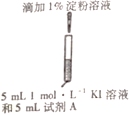
II.某研究小组对碘化钾溶液在空气中发生氧化反应的速率进行实验探究。
(初步探究)
示意图 | 序号 | 温度 | 试剂A | 现象 |
| ① | 0℃ | 0.5 mol·L-1稀硫酸 | 4min左右出现蓝色 |
② | 20℃ | 1min左右出现蓝色 | ||
③ | 20℃ | 0.1 mol·L-1 稀硫酸 | 15min左右出现蓝色 | |
④ | 20℃ | 蒸馏水 | 30min左右出现蓝色 |
(1)为探究量度对反应速率的影响,实验②中试剂A应为___。
(2)写出实验③中I-反应的离子方程式_____。
(3)对比实验②③④,可以得出的结论是_________。
(继续探究)溶液pH对反应速率的影响
查阅资料:
i.pH<11.7时,I-能被O2氧化为I2-。
ii.pH>9.28时,I2-发生歧化反应:3I2-+6OH-=IO3-+5I-+3H2O,pH越大,歧化速率越快
(4)小组同学用4支试管在装有O2储气瓶中进行实验,装置如图所示。
序号 | ⑤ | ⑥ | ⑦ | ⑧ |
试管中溶液的pH | 8 | 9 | 10 | 11 |
放置10小时后的现象 | 出现蓝色 | 颜色无明显变化 | ||
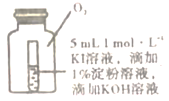
pH为10、11时,试管⑦和⑧中颜色无明显变化的原因是__(填序号)。
A 发生氧化反应又发生歧化反应,歧化反应速率大于氧化反应速率和淀粉变色速率
B 发生氧化反应又发生歧化反应,歧化反应速率小于氧化反应速率和淀粉变色速率
C 生了氧化反应,但没有发生歧化反应
D 生了歧化反应,但没有发生氧化反应