【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。
(查阅资料)
物质 | BaSO4 | BaCO3 | AgI | AgCl |
溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(实验探究)
(一)探究BaCO3和BaSO4之间的转化,实验操作如下所示:
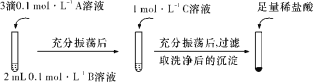
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | ||||
实验Ⅱ | BaCl2 | |||
Na2CO3 | Na2SO4 | …… | ||
Na2SO4 | 有少量气泡产生,沉淀部分溶解 |
(1)实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入稀盐酸后,__________。
(2)实验Ⅱ中加入稀盐酸后发生反应的离子方程式是_________。
(3)实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:___________。
(二)探究AgCl和AgI之间的转化。
(4)实验Ⅲ:证明AgCl转化为AgI。
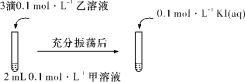
甲溶液可以是______(填字母代号)。
a AgNO3溶液 b NaCl溶液 c KI溶液
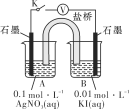
(5)实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
装置 | 步骤 | 电压表读数 |
| ||
ⅰ.按图连接装置并加入试剂,闭合K | a | |
ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | |
ⅲ.再向B中投入一定量NaCl(s) | c | |
ⅳ.重复ⅰ,再向B中加入与ⅲ等量的NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①查阅有关资料可知,Ag+可氧化I-,但AgNO3溶液与KI溶液混合总是得到AgI沉淀,原因是氧化还原反应速率__________(填“大于”或“小于”)沉淀反应速率。设计(-)石墨(s)[I-(aq)//Ag+(aq)]石墨(s)(+)原电池(使用盐桥阻断Ag+与I-的相互接触)如上图所示,则该原电池总反应的离子方程式为________。
②结合信息,解释实验Ⅳ中b<a的原因:__________。
③实验Ⅳ的现象能说明AgI转化为
(实验结论)溶解度小的沉淀容易转化为溶解度更小的沉淀,反之则不易;溶解度差别越大,由溶解度小的沉淀转化溶解度较大的沉淀越难实现。