【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向蛋白质溶液中加入醋酸铅溶液,产生白色沉淀 | 蛋白质发生了盐析 |
B | SO2通入Ba(NO3)2溶液中,产生白色沉淀 | 沉淀为BaSO3 |
C | 向蔗糖中加入适量浓硫酸并搅拌,蔗糖变黑,体积膨胀,并放出刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
D | 分别向等物质的量浓度的苯酚钠溶液和碳酸钠溶液中滴加酚酞,后者红色更深 | 碳酸酸性强于苯酚 |
A.AB.BC.CD.D
【题目】金属及其化合物在国民经济发展中起着重要作用。
(1)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。该过程中负极的电极反应式为_________。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:
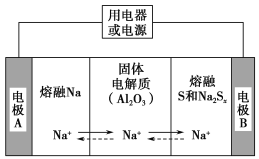
①根据下表数据,请你判断该电池工作的适宜温度应控制在_________。
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2 050 |
沸点/℃ | 892 | 444.6 | 2 980 |
a.100 ℃以下 b.100 ℃~300 ℃
c.300 ℃~350 ℃ d.350 ℃~2 050 ℃
②放电时,电极A为_________极,S发生_________反应。
③放电时,内电路中Na+的移动方向为_________(填写“从A到B”或“从B到A”)。
④充电时,总反应为Na2Sx=2Na+Sx(3<x<5),Na所在电极与直流电源_________极相连,阳极的电极反应式________。
(3)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。
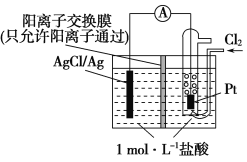
①正极反应为_________。
②当电路中转移0.005 mol e-时,交换膜左侧溶液中约减少_________mol离子。
【题目】亚硝酸氯(ClNO)是有机合成中的重要试剂。亚硝酸氯可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K1
2NaNO3(s)+2NO(g)+Cl2(g) K1
②2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K2
NaNO3(s)+ClNO(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K1、K2、K3之间的关系为K3=____________。
(2)T℃时,2NO(g)+Cl2(g)![]() 2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
2ClNO(g)的正反应速率表达式为υ正=kcn(ClNO),测得速率和浓度的关系如下表:
序号 | c(ClNO)/mol·L-1 | υ/mol·L-1· s-1 |
① | 0.30 | 3.6×10-8 |
② | 0.60 | 1.44×10-7 |
③ | 0.90 | 3.24×10-7 |
n=__________;k=___________(注明单位)。
(3)在2 L的恒容密闭容器中充入4 mol NO(g)和2molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图I。

① 温度为T1时,能作为该反应达到平衡的标志的有__________。
a.气体体积保持不变 b.容器压强保持不变 c.平衡常数K保持不变
d.气体颜色保持不变 e.υ(ClNO)=υ(NO) f.NO与ClNO的物质的量比值保持不变
② 反应开始到10min时,Cl2的平均反应速率υ(Cl2)=_______________。
③ 温度为T2时,10 min时反应已经达到平衡,该反应的平衡常数K=____________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数φ随![]() 的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当
的变化如图II,则A、B、C三个状态中,NO的转化率最小的是____点,当![]() 时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。
时,达到平衡状态时ClNO的体积分数φ可能是D、E、F三点中的_____点。