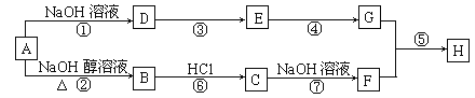
【题目】在100 ℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2![]() N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用二氧化氮表示的平均反应速率为_______mol/(L·s)。
(2)该反应的平衡常数K的数值为____。
(3)若在相同条件下最初向该容器中充入四氧化二氮气体,要达到上述平衡状态,四氧化二氮的起始浓度是______mol·L-1。
(4)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2![]() N2O4的平衡常数将_________(填“增大”“减小”或“不变”)。
N2O4的平衡常数将_________(填“增大”“减小”或“不变”)。
(5)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将_______(填“向左移动”“向右移动”或“不移动”)。
【题目】氯苯是染料、医药、有机合成的中间体,是重要的有机化工产品。实验室制取氯苯的装置如图所示(加热和固定仪器的装置已略去)。
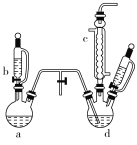
回答下列问题:
(1)如果用a和b仪器组合成制取氯气的装置,反应无需加热,则a仪器中的固体反应物可以是________(填序号)。
A.MnO2 B.KMnO4 C.K2Cr2O7
(2)仪器c的名称是________。
(3)制取氯苯的化学方程式为________________。
(4)仪器d中的反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。碱洗之前要进行水洗,其目的是______________________。
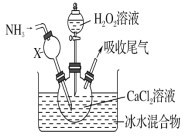
(5)生成的氯气中存在HCl、H2O等杂质气体,若需要增加一个装置除去水蒸气,请在下框中画出,并标明所用试剂。
__________
(6)工业生产中苯的流失情况如表所示:
项目 | 二氯苯 | 氯化尾气 | 蒸气 | 成品 | 不确定苯耗 | 合计 |
苯流失量/(kg·t-1) | 11.7 | 5.4 | 20.8 | 2.0 | 49.3 | 89.2 |
则10 t苯可制得成品氯苯________t。(列出计算式即可。氯苯和苯的相对分子质量分别是112.5和78)