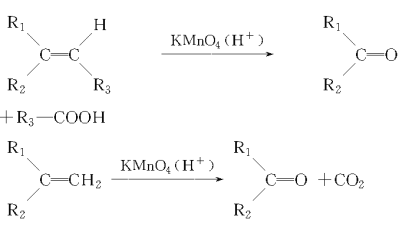
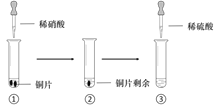
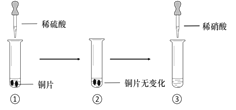
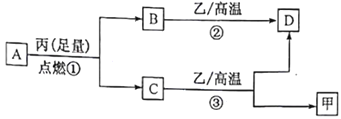
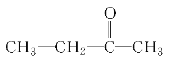【题目】某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
实验1 | 实验2 |
|
|
①、③中溶液呈蓝色,试管口有红棕色气体产生 | ③中溶液呈蓝色,试管口有红棕色气体产生 |
下列说法正确的是
A. 稀硝酸一定被还原为NO2
B. 实验1-②中溶液存在:c(Cu2+) + c(H+) =c(NO3-) + c(OH-)
C. 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D. 实验1-③、实验2-③中反应的离子方程式:3Cu+2NO3-+8H+ =3Cu2++2NO↑+4H2O
【题目】苯胺(又名氨基苯)是最重要的胺类物质之一,可作为炸药中的稳定剂、汽油中的防爆剂,也可作为医药磺胺药的原料等。苯胺为无色油状液体,有特殊气味,可用水蒸气蒸馏提纯。用纳米铁粉还原硝基苯制备苯胺的原理及装置图(略去夹持装置和加热装置)如下:
4![]() +9Fe+4H2O
+9Fe+4H2O![]() 4
4![]() +3Fe3O4
+3Fe3O4
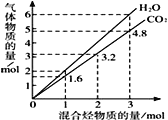
已知部分有机物的一些数据如下表:
名称 | 密度(gmL-1) | 熔点(℃) | 沸点(℃) | 溶解性 | 备注 |
硝基苯 | 1.2037 | 5.7 | 210.8 | 难溶于水,易溶于乙醇、乙醚 | |
苯胺 | 1.0217 | -6.3 | 184.4 | 难溶于水,易溶于乙醇、乙醚 | 空气中易变质 |
乙醚 | 0.7134 | -116.3 | 34.6 | 微溶于水,易溶于乙醇 |
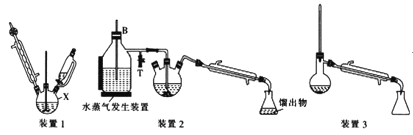
Ⅰ.合成:在装置1中的仪器X中,加入9g纳米铁粉、20mL水、1mL冰醋酸,加热至煮沸,煮沸3~5min后冷却至室温,再将7.0mL硝基苯逐滴加入(该反应强烈放热),搅拌、加热、回流半小时,至反应完全。
Ⅱ.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5~6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)由苯制取硝基苯的化学方程式为__。
(2)仪器X的名称是__;加入硝基苯时,“逐滴加入span>”的目的是__。
(3)分离提纯过程中加入NaCl固体的作用是__。
(4)装置2和装置3都需要通冷凝水,冷凝水的作用是__;装置2中长导管B的作用是__。
(5)萃取分液操作过程中要远离明火和热源,原因是__。
(6)温度T的范围为__,实验结束得到6.0mL产物,则苯胺的产率为__(保留三位有效数字)。