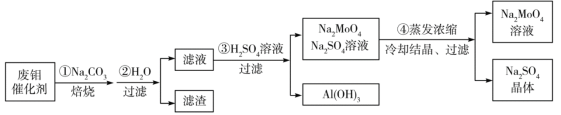
【题目】M 是由两种阳离子、一种阴离子和结晶水组成的化合物。某学习小组的同学对该化合物进行了研究。
Ⅰ、取 M 的样品配成溶液,溶液呈棕黄色。将溶液分成三份,做了下列 3 组实验,分别检出 A、B、C 三种离子。请完成下表中的空格:
组别 | 操作 | 实验现象 | 检出的离子 |
第1组 | 加入足量的NaOH溶液并加热 | 产生的气体使湿润的红色石蕊试纸变蓝 | A:_____ |
第 2 组 | 加入KSCN溶液 | 溶液呈_____色 | B:Fe3+ |
第3组 | 加入_____和 BaCl2 溶液 | 有白色沉淀生成 | C: |
Ⅱ.取 9.640g M 配成溶液,加入足量的NaOH溶液,得到红褐色沉淀,将沉淀过滤、洗涤、灼烧,冷却后称量。经过4次灼烧,称量得到的红棕色固体的质量数据如表所示。
实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
质量 (g ) | 1.630 | 1.610 | 1.600 | 1.600 |
(1)灼烧和称量时需用图所示的仪器,它们的名称分别是:
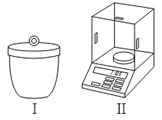
①_____②_____
(2)查阅资料并分析可知红棕色固体为Fe2O3,根据上表数据,可算得Fe2
(3)另取 9.640g M 配成溶液,加入足量的BaCl2溶液,得到白色沉淀,将沉淀过滤、洗涤、干燥,称得其质量为9.320g。小组同学提出 A、B、C 三种离子的物质的量存在以下关系:n (A )+3n (B )=2n (C),他们依据的原理是_____。
(4)分析整个实验过程,可以确定M的化学式为_____。
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量 (g/100mL )。
I.实验步骤:
(1)用_____ (填仪器名称 )量取10.00mL 食用白醋,在_____ (填仪器名称 )中用水稀释后转移到100mL_____ (填仪器名称 )中定容,摇匀即得待测白醋溶液。
(2)用_____色手柄滴定管取待测白醋溶液 20.00mL 于锥形瓶中,向其中滴加2滴_____作为指示剂。
(3)读取盛装0.1000mol/L NaOH 溶液的滴定管的初始读数。如果液面位置如图所示 则此时的读数为_____mL。
![]()
(4)滴定。当_____时,停止滴定,并记录 NaOH溶液的终读数,重复滴定 3 次。
II.实验记录
滴定次数 实验数据 (mL ) | 1 | 2 | 3 | 4 |
V (样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
V (NaOH ) (消耗 ) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)甲同学在处理数据时计算得平均消耗的NaOH溶液的体积为:V= (15.95+15.00+15.05+14.95 )/4=15.24(mL)。指出他的计算的不合理之处:_____。 按正确数据处理,可得c (市售白醋)=_____mol/L。
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是_____ (填写序号)
a.盛装NaOH的滴定管在滴定时未用标准NaOH溶液润洗
b.盛装待测白醋的滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出