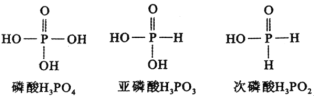
【题目】一定条件下存在反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
CO(g)+H2(g)△H>0;向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | V |
温度 | T1℃ | T2℃ | T1℃ |
起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |

A. 甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B. 丙容器的体积V>0.5L
C. 当温度为T1℃时,反应的平衡常数K=2.25
D. 乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
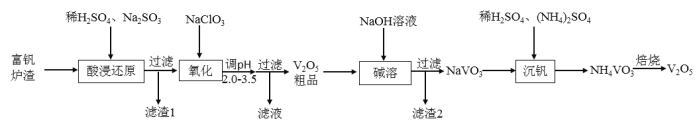
【题目】![]() 是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有
是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有![]() 、
、![]() 和少量
和少量![]() 、
、![]() )中提取,其工艺流程如下:
)中提取,其工艺流程如下:
已知:①![]()
②一些金属阳离子沉淀的pH范围:
开始沉淀pH | 完全沉淀pH | |
| 6.5 | 9.0 |
| 2.2 | 3.5 |
| 4.1 | 5.4 |
(1)“酸浸还原”时![]() 转化为
转化为![]() ,写出有关
,写出有关![]() 反应的离子方程式________;经“氧化”后钒以
反应的离子方程式________;经“氧化”后钒以![]() 存在,写出生成
存在,写出生成![]() 反应的离子方程式________。
反应的离子方程式________。
(2)调节溶液![]() 至2.0~3.5,宜选用的试剂是________(填标号)。/span>
至2.0~3.5,宜选用的试剂是________(填标号)。/span>
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)“滤渣1”的主要成分是________;![]() 粗品中的杂质为________。
粗品中的杂质为________。
(4)“沉钒”时需加入稀![]() ,其目的是________。
,其目的是________。
(5)焙烧产生的气体用________吸收后,其产物可以在该工艺中循环利用。
(6)![]() 在一定条件下可转化为不同价态的钒离子(
在一定条件下可转化为不同价态的钒离子(![]() 、
、![]() 、
、![]() 、
、![]() ),可作为全钒液充电流电池的电极液,电池总反应为
),可作为全钒液充电流电池的电极液,电池总反应为![]() 。下图是钒电池基本工作原理示意图:
。下图是钒电池基本工作原理示意图:
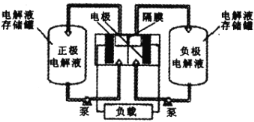
充电时阳极的反应式为____;能够通过钒电池基本工作原理示意图中“隔膜”的离子是_____。