【题目】目前世界上广泛采用氨和二氧化碳高温高压下制备尿素,主要反应为两步:
第一步:生成氨基甲酸铵 | 第二步:氨基甲酸铵脱水生成尿素 |
2NH3(l)+CO2(g) | H2NCOONH4(l)
|
快速放热 | 慢速吸热 |
(1)写出制备尿素的总反应化学方程式:____________________________,该反应热为![]() ,则
,则![]() ______________(“大于”“小于”或“等于”)
______________(“大于”“小于”或“等于”)![]() 。
。
(2)下列说法正确的是________________。
A.利用二氧化碳制备尿素是减缓温室效应的有效方法
B.第二步反应高温条件下自发进行
C.提高投料中的水碳比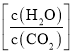 有利于尿素的生成
有利于尿素的生成
D.第一步反应的活化能大于第二步反应
(3)尿素生产过程中转化率通常用二氧化碳转化率来表示,当二氧化碳起始浓度为![]() 时(
时(![]() ,水碳比=0.5),尿素平衡转化率随氨碳比
,水碳比=0.5),尿素平衡转化率随氨碳比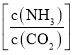 的变化如表所示:
的变化如表所示:
氨碳比/浓度比 | 2.95 | 3.10 | 3.20 | 3.50 |
尿素平衡转化率/% | 56.4 | 57.5 | 57.9 | 60.0 |
提高氨碳比有利于生成尿素,主要有两个原因:一是增大氨气浓度有利于反应正向移动;二是_____________。氨碳比为3.50时,求该状态下的制备尿素总反应平衡常数K=___________.
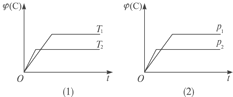
(4)一定条件下,在图中绘制氨基甲酸铵(![]() )在反应过程中物质的量与时间的关系图。
)在反应过程中物质的量与时间的关系图。
 _______________
_______________
(5)通过直接尿素燃料电池装置,实现了“尿素能”的利用,且产生无污染的产物,写出负极反应:____________________________.

【题目】二氧化碳利用具有十分重要的意义,科学家有以下几个设想。
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图:
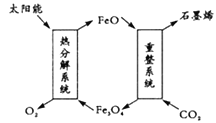
则重整系统发生反应的化学方程式为_________。

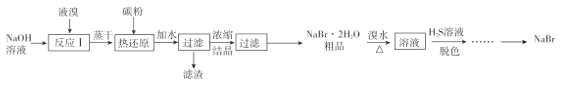
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将________(填“增大”、“ 减小”或“不变”);
②△H_____0(填“>”“<”“ 不能确定”)。
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4 _____H2O (填“>”“<”“ 不能确定”)。
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) △H1=akJ/mol
NH4+(aq)+OH-(aq) △H1=akJ/mol
CO2(g)+H2O(l)![]() H2CO3(aq) △H2=bkJ/mol
H2CO3(aq) △H2=bkJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq)+H2O(l) △H3=ckJ/mol
HCO3-(aq)+H2O(l) △H3=ckJ/mol
则利用NH3 H2O吸收CO2制备NH4HCO3的热化学方程式为______________________;
②已知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5kJ/mol |
Ka1(H2CO3) | 4×10-7kJ/mol |
Ka2(H2CO3) | 4×10-11kJ/mol |
则反应NH4++HCO3-+H2O![]() NH3 H2O+H2CO3的平衡常数K=___________。
NH3 H2O+H2CO3的平衡常数K=___________。
【题目】短周期元素A、B、C、D在元素周期表中的相对位置如表所示,已知A原子最外层电子数与次外层电子数之比为2:1。E和C、D同周期,它的原子序数比B多6。
回答下列问题:
A | B | ||
C | D |
(1)人的汗液中含有D的简单离子,其离子结构示意图为______,元素C在元素周期表中的位置是______。C的最高价氧化物的水化物的浓溶液稀释的方法是______。
(2)A的最高价氧化物的化学式为_____,所含的化学键类型是______(填“离子键”或“共价键”)。
(3)E的最高价氧化物对应的水化物的化学式为____,它是______(填“酸性”或“两性”或“碱性”)化合物。写出该化合物与氢氧化钠溶液反应的离子方程式______。
(4)加热时,B的最高价氧化物对应水合物的浓溶液与单质A反应的化学方程式为(用具体的化学式表示)______。