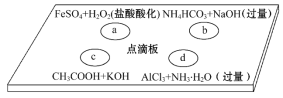
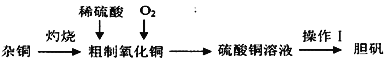
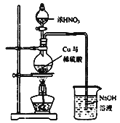
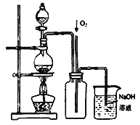
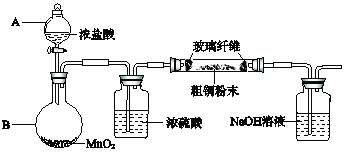
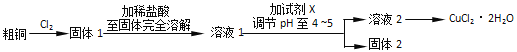0 195571 195579 195585 195589 195595 195597 195601 195607 195609 195615 195621 195625 195627 195631 195637 195639 195645 195649 195651 195655 195657 195661 195663 195665 195666 195667 195669 195670 195671 195673 195675 195679 195681 195685 195687 195691 195697 195699 195705 195709 195711 195715 195721 195727 195729 195735 195739 195741 195747 195751 195757 195765 203614