【题目】I.(1)实验测得 8 g 液态甲醇(化学式为 CH4O)在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出 181.6 kJ 的热量。请写出表示液态甲醇燃烧热的热化学方程式:_______。
(2)发射卫星时常用肼(N2H4)作为燃料,用二氧化氮作为氧化剂,这两种物质反应生成氮气和水蒸气。 已知:①N2(g)+2O2(g)=2NO2(g) ΔH= a kJ/mol;②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH= b kJ/mol。写出肼气体与二氧化氮气体反应的热化学方程式:_______。
II.某学习小组的同学在实验室利用下图装置进行中和热的测定,请回答下列问题:
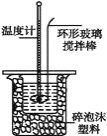
(1)在其它操作正确的前提下,如果大烧杯不盖硬纸板,求得的中和热 ΔH 将_______(填“偏大”、“偏小” 或“无影响”)。
(2)取 50 mL 0.50 mol/L NaOH 溶液和 30 mL 0.50 mol/L 硫酸溶液进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.5 | 26.7 | 26.6 | 30.1 | |
2 | 26.0 | 26.4 | 26.2 | 30.3 | |
3 | 25.9 | 25.9 | 25.9 | 30.2 | |
4 | 26.4 | 26.2 | 26.3 | 30.5 | |
①表中的温度差的平均值为_____℃。
②近似认为 0.50 mol/L NaOH溶液和 0.50 mol/L硫酸溶液的密度都是 1 g·cm-3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热 ΔH=_____kJ/mol (保留到小数点后一位)。
③实验中改用 60 mL0.50 mol/L 盐酸跟 50 mL 0.55 mol/L 氢氧化钠进行反应,若其它实验操作均正确,则与上述实验相比,所放出的热量_____(填“相等”或“不相等”,下同),所求得的中和热_____。