【题目】“绿水青山就是金山银山”,研究NxOy、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式_____________________,该热化学方程式的平衡常数K=______________________(用K1、K2、K3表示)
(2)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X与溶液pH的关系如图所示。
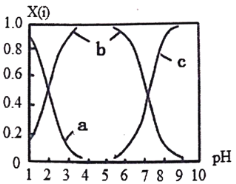
①测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是___________。
②向 NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降低,用化学平衡移动原理解释溶液pH降低的原因________________________。
(3)在一定温度下的恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~40min时段,反应速率v(N2O)为___________mol/(L·min)。
②若N2O起始浓度c0为0.150 mol/L,则反应至30mn时N2O的转化率a=___________。
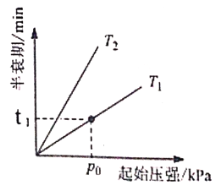
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___________(用p0表示)
【题目】(1)请填写下表:
物质 | 摩尔质量 | 物质的量 | 质量 | 分子或离子数目 |
SO2 | ________ | 2 mol | ________ | ________ |
SO42- | ________ | ________ | ________ | 6.02×1022 |
O2 | ________ | ________ | 8.0 g | ________ |
(2)O2和O3是氧元素的两种单质。根据分子式回答。等质量的O2和O3所含分子数之比为____,原子个数比为____。
(3)摩尔质量是指单位物质的量的物质所含有的质量。
①已知NH3的相对分子质量为17,则NH3的摩尔质量为____。
②1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为____。