某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol·L-1。
阳离子 | K+ Mg2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
① 用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
② 取少量溶液,加入KSCN溶液无明显变化。
③ 另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④ 向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由①、②、③判断,溶液中一定不含有的阳离子是______,一定不含的阴离子是_______(写离子符号)。
(2)③中加入少量盐酸生成无色气体的的离子方程式是_____________,
④中生成白色沉淀的离子方程式是_______________。
(3)将③中所得红棕色气体通入水中,气体变无色,所发生的化学反应方程式为_________。
(4)甲同学最终确定原溶液中所含阳离子是_________,阴离子是________。(写离子符号)
 B.
B. 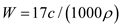
 D. c=1000Vρ/(17V+22400)
D. c=1000Vρ/(17V+22400)
 2AB3(g)”的 ΔH>0
2AB3(g)”的 ΔH>0



 [Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)3]Ac·CO(aq) △H<0