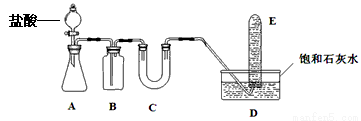
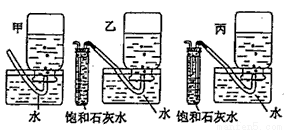
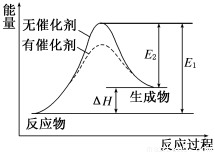
0 175149 175157 175163 175167 175173 175175 175179 175185 175187 175193 175199 175203 175205 175209 175215 175217 175223 175227 175229 175233 175235 175239 175241 175243 175244 175245 175247 175248 175249 175251 175253 175257 175259 175263 175265 175269 175275 175277 175283 175287 175289 175293 175299 175305 175307 175313 175317 175319 175325 175329 175335 175343 203614

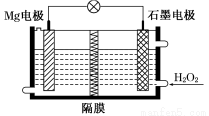
 溶液中Cl-向正极移动
溶液中Cl-向正极移动

 2HI(g)Δ
2HI(g)Δ H<0,达到平衡时,下列说法正确的是( )
H<0,达到平衡时,下列说法正确的是( ) CO(g)+H2O(g)。
CO(g)+H2O(g)。 反应的化学平
反应的化学平 衡常数表达式K=________。
衡常数表达式K=________。