下列关于纯净物,混合物,强电解质,弱电解质和非电解质的正确组合是( )
纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
B | 冰醋酸 | 空气 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
C | 氯气 | 盐酸 | 苛性钠 | 氢硫酸 | 碳酸钙 |
D | 漂白粉 | 氨水 | 氯化钠 | 次氯酸 | 氯气 |
下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12[ | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.多元弱酸的各步电离之间无影响
D.向弱酸溶液中加少量NaOH溶液,电离常数不变
现有常温下c(H+)=0.01mol/L的盐酸甲和c(H+)=0.01mol/L的醋酸溶液乙,回答下列问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据变大的是___________。
A.c(H+) 
 B.c(H+)/c(CH3COOH)
B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡 (填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将 (填“增大”、“减小”或“无法确定”)。
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)__ _________pH(乙)( 填“>”、“<”或“=”)。
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲) V(乙)( 填“>”、“<”或“=”)。
(5)已知25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
K2 | 5.6×10-11 |
下列四种离子结合H+能力最强的是______________。
A.HCO3- B.CO32- C.ClO- D.CH3COO-
请写出在次氯酸钠溶液中通入少量二氧化碳气体的离子方程式:________________。
在2L密闭容器,800℃时发生如下反应:
2CuO(s)+CO(g) Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)写出该反应的平衡常数表达式 。
已知:K(400℃)>K(350℃),则该反应 是 热反应。
是 热反应。
(2)右图中表示Cu2O的物质的量随时间变化的曲线是 (选填“A”或“B”),800℃时,0~3min内该反应的平均速率v (CO2)= 。

(3) 能说明该反应已达到平衡状态的是 。
a.v(CO)=v(CO2) b.容器内压强保持不变
c.v逆(CO)=v正(CO2) d.容器内气体的密度保持不变
(4)能使该反应的正反应速率增大,且平衡向正反应方向移动的是 。
A.增加CuO的量
B.适当升高温度
C.及时移去CO2
D.增大CO的浓度
E.选择高效催化剂
F.增大压强
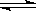 CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( ) 不变
不变 2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH= —99kJ/mol。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)氧化为1molSO3(g)的ΔH= —99kJ/mol。请回答下列问题: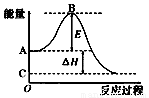
 2C(g)+D(g)
2C(g)+D(g)