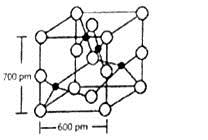
0 174490 174498 174504 174508 174514 174516 174520 174526 174528 174534 174540 174544 174546 174550 174556 174558 174564 174568 174570 174574 174576 174580 174582 174584 174585 174586 174588 174589 174590 174592 174594 174598 174600 174604 174606 174610 174616 174618 174624 174628 174630 174634 174640 174646 174648 174654 174658 174660 174666 174670 174676 174684 203614
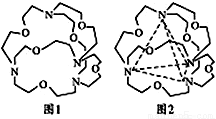
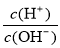 =1×10-12的溶液中:K+、AlO2-、Na+、CO32-
=1×10-12的溶液中:K+、AlO2-、Na+、CO32-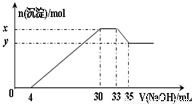
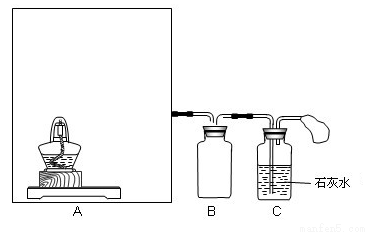
 Na2CO3+X,则X为___________(填化学式)。
Na2CO3+X,则X为___________(填化学式)。