某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是 (填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(3)写出该中和反应的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(4)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
上表中的温度差平均值为 ℃
近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③ 上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
根据所给的信息和标志,判断下列说法错误的是( )
A | B | C | D |
《神农本草经》记载,麻黄能“止咳逆上气” | 碳酸氢钠药片 |
|
|
古代中国人已用麻黄治疗咳嗽 | 该药是抗酸药,服用时喝些醋能提高药效 | 看到有该标志的丢弃物,应远离并报警 | 贴有该标志的物品是可回收物 |
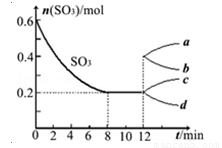
 2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( ) N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )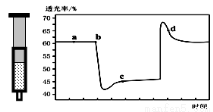
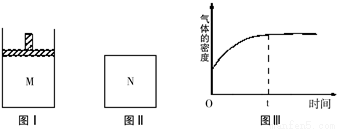






 2NH3(g) △H1KJ/mol,满足如下图像:
2NH3(g) △H1KJ/mol,满足如下图像:
 CO(g)+H2(g) △H=+131.4kJ/mol
CO(g)+H2(g) △H=+131.4kJ/mol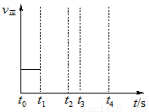
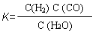 ,它所对应的化学方程式为 。
,它所对应的化学方程式为 。 2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号)
2NH3(g)△H<0的K=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的正确措施是 (填序号) 2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示: