1.下列有关离子(或物质)的检验及结论正确的是( )
| A. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中含有K+ | |
| B. | 向无色溶液中加入BaCl2溶液有白色沉淀出现,则溶液中含有SO42ˉ | |
| C. | 用一束光照射氯化铁溶液和氢氧化铁胶体,都出现丁达尔现象 | |
| D. | 向某溶液中加入NaOH溶液后再加热,若产生的气体能使湿润红色石蕊试纸变蓝,则该溶液中肯定有NH4+ |
20.下列关于Na2CO3固体和NaHCO3固体性质的有关叙述中正确的是( )
| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3与NaHCO3相互转化的反应是可逆反应 |
16.化学无处不在,下列与化学有关的说法正确的是( )
| A. | 氯气工厂爆炸时可用湿布捂住鼻孔、眼睛等并躲在下风的低洼处 | |
| B. | 二氧化硫可用来加工食品,使食品增白 | |
| C. | 锂可用于制造质量轻、电容量大的可充电电池 | |
| D. | 高纯度二氧化硅是制造太阳能电板的材料之一 |
13. X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
(1)Y元素原子的结构示意图为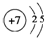 .
.
(2)元素的金属性J>W(填“>”或“<”),下列各项中,能说明这一结论的事实有ACD(填序号)
A.单质与酸反应置换出氢气的难易程度 B.单质的熔点
C.最高价氧化物对应水化物的碱性强弱 D.在金属活动顺序表中的位置
(3)已知:①3W(s)+2Z2(g)=W3Z4(s)△H1=-1118.4kJ/mol
②2X2(g)+Z2(g)=2X2Z(g)△H2=-483.8kJ/mol
则反应3W(s)+4X2Z(g)=W3Z4(s)+4X2(g)的△H=-150.8kJ/mol.
(4)已知反应:2QZ2(g)+Z2(g)?2QZ3(g),QZ2的平衡转化率与温度、压强的关系如图所示:
①压强:P1<P2(填“>”、“=”或“<”).
②200℃下,将一定量的QZ2和Z2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
能说明该反应达到化学平衡状态的是bd.
a.反应速率v(QZ2)=v(QZ3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.QZ2和Z2的体积比保持不变
计算上述反应在0~10min内,v(QZ2)=0.16mol/(L.min).
(5)以YX3为燃料可以设计成燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
0 173893 173901 173907 173911 173917 173919 173923 173929 173931 173937 173943 173947 173949 173953 173959 173961 173967 173971 173973 173977 173979 173983 173985 173987 173988 173989 173991 173992 173993 173995 173997 174001 174003 174007 174009 174013 174019 174021 174027 174031 174033 174037 174043 174049 174051 174057 174061 174063 174069 174073 174079 174087 203614
 X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:
X、Y、Z、J、Q、W六种元素,原子序数依次增大,其中X、Y、Z、J、Q是短周期主族元素.元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y的氧化物是形成酸雨的主要物质之一.W是应用最广泛的金属元素.请回答:(1)Y元素原子的结构示意图为
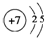 .
.(2)元素的金属性J>W(填“>”或“<”),下列各项中,能说明这一结论的事实有ACD(填序号)
A.单质与酸反应置换出氢气的难易程度 B.单质的熔点
C.最高价氧化物对应水化物的碱性强弱 D.在金属活动顺序表中的位置
(3)已知:①3W(s)+2Z2(g)=W3Z4(s)△H1=-1118.4kJ/mol
②2X2(g)+Z2(g)=2X2Z(g)△H2=-483.8kJ/mol
则反应3W(s)+4X2Z(g)=W3Z4(s)+4X2(g)的△H=-150.8kJ/mol.
(4)已知反应:2QZ2(g)+Z2(g)?2QZ3(g),QZ2的平衡转化率与温度、压强的关系如图所示:
①压强:P1<P2(填“>”、“=”或“<”).
②200℃下,将一定量的QZ2和Z2充入体积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | QZ2 | Z2 | QZ3 |
| 浓度(mol/L) | 0.4 | 1.2 | 1.6 |
a.反应速率v(QZ2)=v(QZ3)
b.体系的压强保持不变
c.混合气体的密度保持不变
d.QZ2和Z2的体积比保持不变
计算上述反应在0~10min内,v(QZ2)=0.16mol/(L.min).
(5)以YX3为燃料可以设计成燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为2NH3-6e-+6OH-=N2+6H2O.
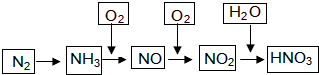

 +(2n-1)H2O.
+(2n-1)H2O.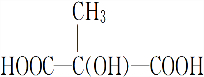 .
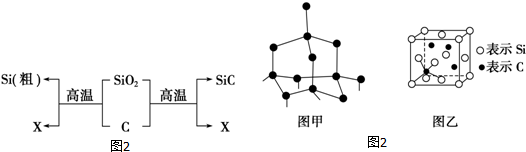
.
 Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题: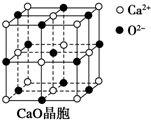 可以由下列反应合成三聚氰胺:
可以由下列反应合成三聚氰胺: 俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸
俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸 后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.
后,三聚氰酸与三聚氰胺分子相互之间通过C结合,在肾脏内易形成结石.