4.将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质的物质的量浓度分别为C1和C2的两种溶液,则C1和C2的关系是( )
| A. | C1=C2 | B. | C1>C2 | C. | C1<C2 | D. | 无法确定 |
3.限用一种试剂,经过一次实验就能鉴别Na2SO4、(NH4)2SO4、NH4Cl、NaCl等4种溶液,应选用( )
| A. | AgNO3 溶液 | B. | NaOH溶液 | C. | Ba(OH)2溶液 | D. | 盐酸 |
2.取两份铝片,第一份与足量稀硫酸反应,第二份与足量NaOH溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为( )
| A. | 2:3 | B. | 1:1 | C. | 3:2 | D. | 1:3 |
1.将30mL 1mol/L NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为( )
| A. | 0.03 mol/L | B. | 0.04 mol/L | C. | 0.05 mol/L | D. | 0.06mol/L |
20.下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A. | 生石灰、氯水、漂白粉 | B. | 烧碱、液氯、氨水 | ||
| C. | 干冰、钢、空气 | D. | 盐酸、氮气、胆矾 |
17.镍是有机合成的重要催化剂.某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质).某学习小组设计如图流程利用含镍催化剂废品制备硫酸镍晶体: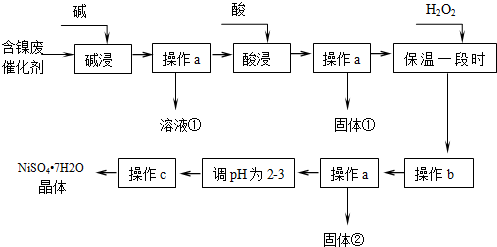
几种难溶碱开始沉淀和完全沉淀的pH如表:
回答下列问题:
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.双氧水可以用下列物质替代的是A.
A.氧气 B.高锰酸钾 C.氯气 D.硝酸
(3)取2.0000g硫酸镍晶体样品溶于蒸馏水,用0.2mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.滴定反应为Ni2++H2Y2-=NiY2-+2H+.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).
(4)操作b调节溶液范围为3.2-7.1,其目的是除去Fe3+.固体②的化学式为Fe(OH)3.
(5)操作a和c需要使用的仪器除铁架台(带铁圈)、烧杯、酒精灯、玻璃棒外还需要的主要玻璃仪器是漏斗.上述流程中,“酸浸”时所加入的酸是H2SO4(填化学式).
0 173789 173797 173803 173807 173813 173815 173819 173825 173827 173833 173839 173843 173845 173849 173855 173857 173863 173867 173869 173873 173875 173879 173881 173883 173884 173885 173887 173888 173889 173891 173893 173897 173899 173903 173905 173909 173915 173917 173923 173927 173929 173933 173939 173945 173947 173953 173957 173959 173965 173969 173975 173983 203614

几种难溶碱开始沉淀和完全沉淀的pH如表:
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(1)溶液①中含金属元素的离子是AlO2-.
(2)用离子方程式表示加入双氧水的目的2Fe2++H2O2+2H+=2Fe3++2H2O.双氧水可以用下列物质替代的是A.
A.氧气 B.高锰酸钾 C.氯气 D.硝酸
(3)取2.0000g硫酸镍晶体样品溶于蒸馏水,用0.2mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50mL.滴定反应为Ni2++H2Y2-=NiY2-+2H+.计算样品纯度为97.0%.(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应).
(4)操作b调节溶液范围为3.2-7.1,其目的是除去Fe3+.固体②的化学式为Fe(OH)3.
(5)操作a和c需要使用的仪器除铁架台(带铁圈)、烧杯、酒精灯、玻璃棒外还需要的主要玻璃仪器是漏斗.上述流程中,“酸浸”时所加入的酸是H2SO4(填化学式).