题目内容
19.以CH4和H2O为原料,通过下列反应来制备甲醇.Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.0kJ•mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g)△H=-129.0kJ•mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CH3OH (g)+H2(g)△H=+77kJ•mol-1.
分析 根据盖斯定律I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ•mol-1
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ•mol-1
依据盖斯定律,Ⅰ+Ⅱ得到要书写的热化学方程式.
解答 解:I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ•mol-1
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ•mol-1
依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ•mol-1.
点评 本题考查热化学方程式书写、盖斯定律和相关计算,掌握基础是解本题的关键,题目难度中等.

练习册系列答案
相关题目
9.“保护环境”是我国的基本国策.下列做法不应该提倡的是( )
| A. | 焚烧秸秆,还肥于田 | B. | 净化废水,循环利用 | ||
| C. | 低碳出行,植树造林 | D. | 开发风能,利用地热 |
10.将下列各组物质溶于水后,得到无色溶液的一组是( )
| A. | K2SO4、HNO3、BaCl2 | B. | NaOH、NH4Cl、Mg(NO3)2 | ||
| C. | NH4HCO3、KCl、NaCl | D. | KMnO4、NaCl、H2SO4 |
7.下列指定反应的离子方程式正确的是( )
| A. | 实验室用烧碱溶液除去尾气中的Cl2:Cl2+OH-═Cl-+HClO | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| C. | 石灰水中加入过量小苏打溶液:2HCO3-+Ca2++2OH-=CaCO3↓+CO32+2H2O | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
14.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如表:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应水化物既能和酸反应又能和强碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题: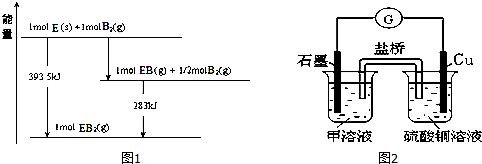
(1)A元素在周期表中的位置是第二周期第VA族.
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种)酸雨或光化学烟雾;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若使所得溶液pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.某同学假设正极产物是Fe2+,请你设计实验证明该假设滴加酸性高锰酸钾溶液,若溶液紫色褪去(或滴加铁氰化钾溶液,产生蓝色沉淀),则产品中含有Fe2+.

| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题有:(任写一种)酸雨或光化学烟雾;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若使所得溶液pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.某同学假设正极产物是Fe2+,请你设计实验证明该假设滴加酸性高锰酸钾溶液,若溶液紫色褪去(或滴加铁氰化钾溶液,产生蓝色沉淀),则产品中含有Fe2+.
4.将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质的物质的量浓度分别为C1和C2的两种溶液,则C1和C2的关系是( )
| A. | C1=C2 | B. | C1>C2 | C. | C1<C2 | D. | 无法确定 |
8.下列叙述正确的是( )
| A. | 铁分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 一定条件下,铁粉与水蒸气可在高温下反应生成氢氧化铁 | |
| C. | Fe3+中的Fe2+可用KSCN溶液检验 | |
| D. | 稀硫酸不能和铜反应,但在上述混合物中加入Fe2O3 后铜能溶解 |