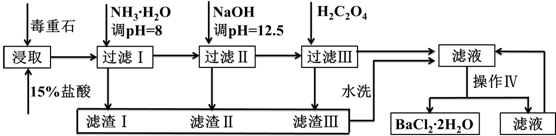
15.下列说法正确的是( )
| A. | 298K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H>0 | |
| B. | 乙醇、乙二醇、丙三醇互为同系物;H2、D2、T2互为同素异形体 | |
| C. | 用一定浓度的稀盐酸滴定未知浓度的氨水,若选用酚酞作指示剂,会使测定出的氨水物质的量浓度偏低 | |
| D. | 饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,涉及原理相同 |
13. 将一定量的二氧化碳通入100毫升某浓度的氢氧化钠溶液中得到溶液X,若向X中逐渐加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计二氧化碳溶解)( )
将一定量的二氧化碳通入100毫升某浓度的氢氧化钠溶液中得到溶液X,若向X中逐渐加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计二氧化碳溶解)( )
 将一定量的二氧化碳通入100毫升某浓度的氢氧化钠溶液中得到溶液X,若向X中逐渐加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计二氧化碳溶解)( )
将一定量的二氧化碳通入100毫升某浓度的氢氧化钠溶液中得到溶液X,若向X中逐渐加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计二氧化碳溶解)( )| A. | 若OA=AB,则溶液X为碳酸钠溶液 | |
| B. | 若OA=0,则形成溶液X所发生反应的离子方程式为OH-+CO2=HCO3- | |
| C. | 若OA>AB,则溶液X中大量存在的阴离子为碳酸根离子和碳酸氢根离子 | |
| D. | 若3OA=AB,则溶液X中c(NaHCO3)=2c(Na2CO3) |
11.某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.进行如图实验:下列有关说法正确的是( )


| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的物质一定是Cu | |
| C. | 根据上述步骤Ⅱ可以得出m(Fe2O3):m(Cu)=1:1 | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 |
10.Cu、Cu2O和CuO组成的混合物加入100mL 0.6mol/L HNO3溶液中,恰好使混合物溶解,同时收集到224mL NO气体(标准状况).下列说法不正确的是( )
| A. | 产物中硝酸铜的物质的量为0.025 mol | |
| B. | 若混合物中Cu的物质的量为0.005 mol,则其中Cu2O、CuO的物质的量共0.020 mol | |
| C. | 若混合物中含0.01 mol Cu,则其中Cu2O、CuO的物质的量均为0.005 mol | |
| D. | 混合物中Cu的物质的量的取值范围为0.005 mol<n(Cu)<0.015 mol |
9.在无色透明的溶液中,由水电离出C(OH-)=10-12 mol•L-1,下列可能大量共存的离子组 是( )
| A. | Ba2+、NH4+、Cl-、AlO2- | B. | Na+、NO3-、SO42-、I- | ||
| C. | Na+、HCO3-、Cl-、SO4 2- | D. | Fe3+、K+、Cl-、NO3- |
8.下列叙述中正确的是( )
0 173725 173733 173739 173743 173749 173751 173755 173761 173763 173769 173775 173779 173781 173785 173791 173793 173799 173803 173805 173809 173811 173815 173817 173819 173820 173821 173823 173824 173825 173827 173829 173833 173835 173839 173841 173845 173851 173853 173859 173863 173865 173869 173875 173881 173883 173889 173893 173895 173901 173905 173911 173919 203614
| A. | 氯化铝溶液中加入过量氨水反应的实质是Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| B. | 存在于污水中的重金属离子,常用投加明矾等电解质的方法进行处理 | |
| C. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO$\frac{\underline{\;高温\;}}{\;}$3Mg+Al2O3 |
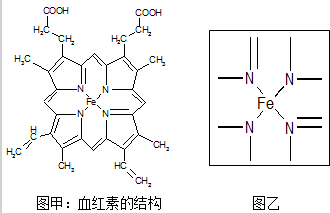
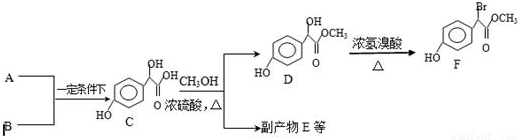
 .
.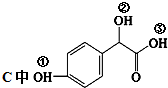 ①、②、③3个-OH的酸性由强到弱的顺序是:
①、②、③3个-OH的酸性由强到弱的顺序是: .
.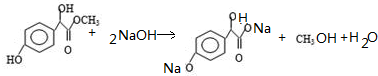 .
.