20.下列说法中正确的是( )
| A. | 由C(s金刚石)=C(s石墨)△H=-1.19kJ/mol可知石墨比金刚石稳定 | |
| B. | 等质量的硫固体和硫蒸气分别完全燃烧,前者放出的热量多 | |
| C. | 热化学方程式中的化学计量数可以表示反映物质和生成物的微粒个数 | |
| D. | 2g H2完全燃烧生成液态水是将放出285.8kJ的热,则此反应的热化学方程式为2H2O(l)=2H2(g)+O2(l)△H=-285.8KJ/mol |
19.医学家最近合成了一种具有抗癌活性的化合物Depudecin,该物质也曾从真菌里分离出来,其结构简式如下: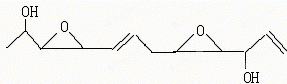
下列关于该化合物的说法正确的是( )

下列关于该化合物的说法正确的是( )
| A. | 该化合物的分子式为C12H16O4 | |
| B. | 该化合物属于有机酯类,所以可以发生水解反应 | |
| C. | 该化合物既可以发生消去反应,也可以被催化氧化生成醛 | |
| D. | 1mol该化合物可以和2mol醋酸发生取代反应 |
13.下列晶体中不属于原子晶体的是( )
| A. | 水晶 | B. | 金刚石 | C. | 干冰 | D. | 晶体硅 |
12. 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如表.则该温度下反应的平衡常数K=1.2(保留2位有效数字)
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1H2,此时v(正)< v(逆)(填“>”“=”或“<”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
(3)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响.
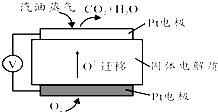
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(6)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
反应b中理论上原子利用率为46%.
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如表.则该温度下反应的平衡常数K=1.2(保留2位有效数字)
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1.
(3)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响.
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(6)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
反应b中理论上原子利用率为46%.
11.2015年7月19日央视《每周质量报告》曝光,近9成EVA儿童地垫含甲酰胺(结构简式 ),EVA
),EVA
材质是乙烯一醋酸乙烯共聚物材质.甲酰胺有生殖毒性,180℃开始部分分解生成CO和NH3,伤害眼睛、皮肤黏膜.下列说法正确的是.
0 173565 173573 173579 173583 173589 173591 173595 173601 173603 173609 173615 173619 173621 173625 173631 173633 173639 173643 173645 173649 173651 173655 173657 173659 173660 173661 173663 173664 173665 173667 173669 173673 173675 173679 173681 173685 173691 173693 173699 173703 173705 173709 173715 173721 173723 173729 173733 173735 173741 173745 173751 173759 203614
 ),EVA
),EVA材质是乙烯一醋酸乙烯共聚物材质.甲酰胺有生殖毒性,180℃开始部分分解生成CO和NH3,伤害眼睛、皮肤黏膜.下列说法正确的是.
| A. | EVA材质属于高分子化合物材质 | |
| B. | NH3溶于水能导电,所以NH3是电解质 | |
| C. | 甲酰胺的摩尔质量为45 | |
| D. | 甲酰胺分解生成CO和NH3属于氧化还原反应 |
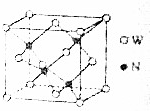 X、Y、Z、W、N是原子序数依次增大的前四周期元素,其中X的s能级电子数是p能级电子数的2倍,Y的原子核外有3个未成对电子,Z的基态原子M层与K层电子数相等,Y与Z的最外层电子数之和等于W的最外层电子数,N+原子核外有3个电子层且各层均处于全满状态.回答下列问题:
X、Y、Z、W、N是原子序数依次增大的前四周期元素,其中X的s能级电子数是p能级电子数的2倍,Y的原子核外有3个未成对电子,Z的基态原子M层与K层电子数相等,Y与Z的最外层电子数之和等于W的最外层电子数,N+原子核外有3个电子层且各层均处于全满状态.回答下列问题: