11.下列说法不正确的是( )
| A. | 已知冰的熔化热为6.0kJ/mol,冰中氢键键能为20kJ/mol,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中30%的氢键 | |
| B. | 一定温度下,醋酸溶液物质的量浓度为C,电离度为α,Kα=$\frac{(Ca)^{2}}{C(1-a)}$.若加入少量CH3COONa固体,则电离平衡向左移动,α减小,Kα不变 | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 进行中和热反应中,如果不把温度计上的酸用水冲洗掉,那么根据cm△t计算得到的Q结果会偏小 |
10.如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列分析正确的是( )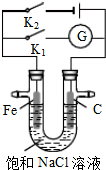

| A. | K1闭合,铁棒上发生的反应为2H++2e-→H2↑ | |
| B. | K1闭合,石墨棒周围溶液pH逐渐降低 | |
| C. | K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法 | |
| D. | K2闭合,电路中通过0.4NA个电子时,两极共产生4.48L气体 |
8.工业生产水煤气的反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol-1下列判断正确的是( )
| A. | 水煤气反应中,生成1molH2(g)吸收131.4 kJ热量 | |
| B. | CO(g)+H2(g)?C(s)+H2O(g)△H=+131.4kJ•mol-1 | |
| C. | 水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 | |
| D. | 反应物能量总和大于生成物能量总和 |
7.为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是
( )
| 实验目的 | 主要仪器 | 试剂 | |
| A | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
| B | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| C | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| D | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| A. | A | B. | B | C. | C | D. | D |
4. 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热△H为-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
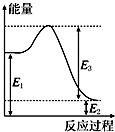
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)?CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)值如表:
则△H1=-116kJ•mol-1,在相应的反应条件下,将1mol CO(g)与足量H2(g)充分混合反应只生成CH3OH(g)后,反应焓变>△H1.(用“>”、“<”或“=”填空)
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)氢气的燃烧热△H为-285.8kJ•mol-1,写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6kJ•mol-1.
(2)现有1mol由H2O(g)与O2组成的混合气体,且O2的体积分数为x,将此混合气体与足量CH4充分反应.当x=0.75时,反应②与③放出(或吸收)的总能量为0.若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ B.E2=36kJ C.E1-E2=36kJ D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)?CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)值如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能(kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
3. 完成下列各题:
完成下列各题:
(1)已知下列反应的热化学方程式:
①6C (s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1;
②2H2(g)+O2 (g)=2H2O(g)△H2;
③C(s)+O2(g)═CO2(g)△H3.
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为12△H3+5△H2-2△H1.
(2)向体积为10L的恒容密闭容器中通入3mol X,在一定温度下发生如下反应:2X(g)?Y(g)+az(g),经5min后反应达到反应限度(即达到平衡状态).
①平衡时,测得容器内的压强为起始时的1.2倍,此时X的物质的量浓度为0.24mol•L-1,则方程式中a=3;用Y表示的反应速率为0.006mol•L-1•min-1.
②若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得容器内的反应速率如表所示:
若四个容器中仅反应温度不同,则反应温度最低的是丙(填序号)
(3)高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.
①则阳极的电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O;
②若隔膜为阴离子交换膜,则OH-自左向右移动(填左、右):
③假设电解前后体积变化忽略不计,撤去隔膜混合后,与原溶液比较pH降低(升高、降低或不变)
 完成下列各题:
完成下列各题:(1)已知下列反应的热化学方程式:
①6C (s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1;
②2H2(g)+O2 (g)=2H2O(g)△H2;
③C(s)+O2(g)═CO2(g)△H3.
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为12△H3+5△H2-2△H1.
(2)向体积为10L的恒容密闭容器中通入3mol X,在一定温度下发生如下反应:2X(g)?Y(g)+az(g),经5min后反应达到反应限度(即达到平衡状态).
①平衡时,测得容器内的压强为起始时的1.2倍,此时X的物质的量浓度为0.24mol•L-1,则方程式中a=3;用Y表示的反应速率为0.006mol•L-1•min-1.
②若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一时间内测得容器内的反应速率如表所示:
| 容器 | 反应速率 | 容器 | 反应速率 |
| 甲 | v(X)=3.5mol•L-1•min-1 | 乙 | v(Y)=2 mol•L-1•min-1 |
| 丙 | v(Z)=4.5mol•L-1•min-1 | 丁 | v(X)=0.075mol•L-1•s-1 |
(3)高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.
①则阳极的电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O;
②若隔膜为阴离子交换膜,则OH-自左向右移动(填左、右):
③假设电解前后体积变化忽略不计,撤去隔膜混合后,与原溶液比较pH降低(升高、降低或不变)
2.下列有关电解实验的说法不正确的是( )
0 173385 173393 173399 173403 173409 173411 173415 173421 173423 173429 173435 173439 173441 173445 173451 173453 173459 173463 173465 173469 173471 173475 173477 173479 173480 173481 173483 173484 173485 173487 173489 173493 173495 173499 173501 173505 173511 173513 173519 173523 173525 173529 173535 173541 173543 173549 173553 173555 173561 173565 173571 173579 203614
| A. | 使用肼-空气碱性燃料电池作为电解精炼铜的电源,阴极的质量变化128 g,则肼-空气碱性燃料电池理论上消耗标准状况下空气的体积为112 L(假设空气中氧气的体积分数为20%) | |
| B. | 若在电解水时加入少量硫酸钠,则电解水结束后溶液的pH将会保持不变 | |
| C. | 电解硫酸铜溶液一小段时间后,为了使电解质溶液复原,可以加入适量的Cu(OH)2 | |
| D. | 电解硫酸铜溶液产生氧气1.12 L(标准状况)时,转移电子0.2 mol |
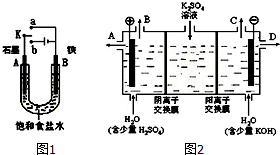 某课外活动小组同学用如图1装置进行实验,试回答下列问题.
某课外活动小组同学用如图1装置进行实验,试回答下列问题. 对如图中两极进行必要的连接并填空:
对如图中两极进行必要的连接并填空: