2.在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)═M(g)+N(g),所得实验数据如下表:
请计算:
(1)实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N);
(2)实验②中,该反应的平衡常数K;
(3)实验③中,达到平衡时,X的转化率.
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
(1)实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N);
(2)实验②中,该反应的平衡常数K;
(3)实验③中,达到平衡时,X的转化率.
1.(1)在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应.各物质的起始加入量如下:A、B和C均为4.0mol、D为6.5mol、F为2.0mol,设E为x mol.当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置.请填写以下空白:
①若x=4.5,则右侧反应在起始时向正反应 (填“正反应“或“逆反应“)方向进行.欲使起始反应维持向该方向进行,则x的最大取值应小于7.0.
②若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?不相等 (填“相等“、“不相等“或“不能确定“).其理由是:因为这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以物质的量也不同.
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0 试回答下列问题:
①若起始时c(CO)=2mol•L-1,c(H2O)=3mol•L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=1;
②在相同温度下,若起始时c(CO)=2mol•L-1,c(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时v(正)>v(逆)(填“大于”“小于”或“等于”),达到平衡时CO的转化率为50%;
③若降低温度,该反应的K值将增大(填“增大”“减小”或“不变”,下同),该反应的化学反应速率将减小.
| A (g)+B (g)?2C (g) | D(g)+2E(g)?2F(g) |
②若x分别为4.5和5.0,则在这两种情况下,当反应达平衡时,A的物质的量是否相等?不相等 (填“相等“、“不相等“或“不能确定“).其理由是:因为这两种情况是在两个不同温度下达到化学平衡的,平衡状态不同,所以物质的量也不同.
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0 试回答下列问题:
①若起始时c(CO)=2mol•L-1,c(H2O)=3mol•L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=1;
②在相同温度下,若起始时c(CO)=2mol•L-1,c(H2O)=2mol•L-1,反应进行一段时间后,测得H2的浓度为0.5mol•L-1,则此时v(正)>v(逆)(填“大于”“小于”或“等于”),达到平衡时CO的转化率为50%;
③若降低温度,该反应的K值将增大(填“增大”“减小”或“不变”,下同),该反应的化学反应速率将减小.
20.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2 (g)$\stackrel{高温}{?}$ W(s)+3H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;580℃时,固体物质的主要成分为W2O5、WO2;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为1:1:4.
(4)已知:温度过高时,WO2(s)转变为WO2(g);
WO2(s)+2H2(g)═W(s)+2H2O (g)△H=+66.0kJ•mol-1
WO2(g)+2H2(g)═W(s)+2H2O (g)△H=-137.9kJ•mol-1
则WO2(s)═WO2(g) 的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为W(s)+2I2 (g)$?_{约3000℃}^{1400℃}$ WI4 (g).下列说法正确的有ab.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2(s)转变为WO2(g);
WO2(s)+2H2(g)═W(s)+2H2O (g)△H=+66.0kJ•mol-1
WO2(g)+2H2(g)═W(s)+2H2O (g)△H=-137.9kJ•mol-1
则WO2(s)═WO2(g) 的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为W(s)+2I2 (g)$?_{约3000℃}^{1400℃}$ WI4 (g).下列说法正确的有ab.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
18. 碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82-+2I-═2SO42-+I2(慢)
I2+2S2O32-═2I-+S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的S2O32-或Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2:1.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
表中Vx=2.0mL,理由是保证溶液总体积不变,即其他条件不变,只改变反应物K2S2O8浓度,从而才达到对照实验目的.
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~反应时间t的变化曲线示意图(进行相应的标注).
 碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:S2O82-+2I-═2SO42-+I2(慢)
I2+2S2O32-═2I-+S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的S2O32-或Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2:1.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
| 实验 序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~反应时间t的变化曲线示意图(进行相应的标注).
17.恒温下,将1mol N2和3mol H2在体积为2L的容器中混合,发生如下反应:N2(g)+3H2(g)?2NH3(g),2s时测得NH3的体积分数为25%.则下列说法中不正确的是( )
| A. | 2s时N2的转化率为40% | |
| B. | 2s时混合气体中n(N2):n(H2):n(NH3)=3:9:4 | |
| C. | 2s时NH3的浓度为0.4mol•L-1 | |
| D. | 用N2浓度的减少表示的平均反应速率为0.2mol•L-1•s-1 |
15. 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表.
则该温度下反应的平衡常数K=1.2.(保留2位有效数字)
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1H2,此时v (正)< v (逆)(填“>”“=”或“<”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1'.
(3)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响增加压强使反应速率加快,同时平衡右移,CH3OH产率增大.
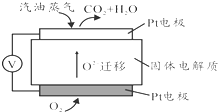
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如右图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(6)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(7)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照、叶绿素}{→}$ C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是a,反应b中理论上原子利用率为46%.
0 173352 173360 173366 173370 173376 173378 173382 173388 173390 173396 173402 173406 173408 173412 173418 173420 173426 173430 173432 173436 173438 173442 173444 173446 173447 173448 173450 173451 173452 173454 173456 173460 173462 173466 173468 173472 173478 173480 173486 173490 173492 173496 173502 173508 173510 173516 173520 173522 173528 173532 173538 173546 203614
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1H2,此时v (正)< v (逆)(填“>”“=”或“<”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1'.
(3)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响增加压强使反应速率加快,同时平衡右移,CH3OH产率增大.
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如右图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(6)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(7)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照、叶绿素}{→}$ C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是a,反应b中理论上原子利用率为46%.