1.设NA为阿伏加德罗常数的数值,在常温常压下,下列说法正确的是( )
| A. | 18g水所含分子数目为NA,体积约为24.5L | |
| B. | 0.1mol•L-1的NaNO3溶液中含有0.1NA个NO3- | |
| C. | 1mol Fe与足量的盐酸反应,转移3NA个电子 | |
| D. | 2.3g钠离子所含电子数目为1NA |
19.相关物质的溶度积常数见表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入CuO、Cu(OH)2、CuCO3或 Cu2(OH)2CO3,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9 mol•L-1.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是CuCl2•2H2O在加热时会发生水解(可能混有CuCl2、Cu(OH)2、Cu(OH)Cl、CuO等杂质),.由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.已知:2Cu2++4I-=2CuI↓+I2; I2+2S2O32-=S4O62-+2I-.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是溶液蓝色褪去,且半分钟之内不恢复原色.
②该试样中CuCl2•2H2O的质量百分数为95%.
③若滴定终点时俯视滴定管刻度,则由此测得的CuCl2•2H2O的质量分数会偏小.(填“偏大”、“偏小”或“不变”,下同)
④若加入KI后,部分I-因被空气中的氧气氧化,则导致测得的CuCl2•2H2O的质量百分数的值会偏大.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是CuCl2•2H2O在加热时会发生水解(可能混有CuCl2、Cu(OH)2、Cu(OH)Cl、CuO等杂质),.由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.已知:2Cu2++4I-=2CuI↓+I2; I2+2S2O32-=S4O62-+2I-.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是溶液蓝色褪去,且半分钟之内不恢复原色.
②该试样中CuCl2•2H2O的质量百分数为95%.
③若滴定终点时俯视滴定管刻度,则由此测得的CuCl2•2H2O的质量分数会偏小.(填“偏大”、“偏小”或“不变”,下同)
④若加入KI后,部分I-因被空气中的氧气氧化,则导致测得的CuCl2•2H2O的质量百分数的值会偏大.
16.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| B. | 向氢氧化钠溶液中通入二氧化碳:2OH-+CO2=CO32-+H2O | |
| C. | 澄清石灰水与稀盐酸反应:Ca (OH)2+2H+=Ca2++2H2O | |
| D. | 铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu |
13.用下列装置进行相应实验,装置正确且能达到实验目的是( )
0 173333 173341 173347 173351 173357 173359 173363 173369 173371 173377 173383 173387 173389 173393 173399 173401 173407 173411 173413 173417 173419 173423 173425 173427 173428 173429 173431 173432 173433 173435 173437 173441 173443 173447 173449 173453 173459 173461 173467 173471 173473 173477 173483 173489 173491 173497 173501 173503 173509 173513 173519 173527 203614
| A. | 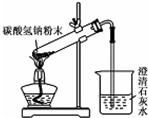 用图所示装置验证NaHCO3的不稳定性 用图所示装置验证NaHCO3的不稳定性 | |
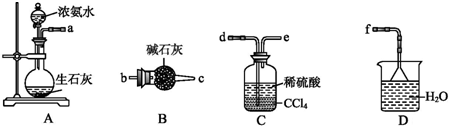
| B. |  用图所示装置干燥氨气 用图所示装置干燥氨气 | |
| C. | 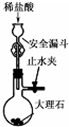 用图所示装置制取少量CO2气体 用图所示装置制取少量CO2气体 | |
| D. |  用图所示装置分馏石油 用图所示装置分馏石油 |
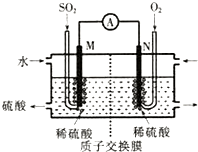 硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料):M极发生的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料):M极发生的电极反应式为SO2+2H2O-2e-=SO42-+4H+. 工业制硫酸过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)△H<0.按照相同的物质的量投料,测得SO2在不同温度下的平衡转
工业制硫酸过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)△H<0.按照相同的物质的量投料,测得SO2在不同温度下的平衡转