11.有一含Na+的无色透明溶液,只可能含有以下离子中的若干种:K+、NH4+、Cu2+、Cl-、Mg2+、Ba2+、CO32-、SO42-,为了确定溶液中所含离子及其物质的量浓度,某同学设计实验如下,取三份100mL上述水溶液进行如下实验.
根据上述实验,请回答
(1)溶液中肯定不存在的离子是Cu2+、Mg2+、Ba2+,不能确定是否存在的离子是K+、Cl-.
(2)请用离子方程式表示沉淀减少的原因BaCO3+2H+=Ba2++H2O+CO2↑.
(3)对于存在的且能定量计算出离子浓度,请写出它们的物质的量浓度:c(NH4+)=0.3mol•L-1,c(CO32-)=0.1mol•L-1,c(SO42-)=0.2mol•L-1 .
根据上述实验,请回答
| 操作 | 实验现象 | |
| ①第一份加入AgNO3溶液 | 有白色沉淀产生 | |
| ②第二份加入足量NaOH溶液,加热 | 收集到气体672mL(标准状况) | |
| ③第三份先加入足量BaCl2溶液,再向产生的沉淀中加入足量盐酸经洗涤、干燥后 | 先产生干燥沉淀6.63g, 之后沉淀变为4.66g | |
(2)请用离子方程式表示沉淀减少的原因BaCO3+2H+=Ba2++H2O+CO2↑.
(3)对于存在的且能定量计算出离子浓度,请写出它们的物质的量浓度:c(NH4+)=0.3mol•L-1,c(CO32-)=0.1mol•L-1,c(SO42-)=0.2mol•L-1 .
9.在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2 (g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(2)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L.s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$.
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.(多选)
A.N2O4的转化率越高B.NO2的产量越大
C.N2O4与NO2的浓度之比越大D.正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4起始浓度B.向混合气体中通入NO2C.使用高效催化剂D.升高温度
(6)当反应达到平衡后,下列操作,不能使平衡混合气体颜色加深的是D
A.恒温恒容下再通入N2O4气体
B.恒温恒容下再通入NO2气体
C.恒容时,升高温度
D.恒温恒容时通入Ar
E.恒温时压缩体积.
| n/mol 时间/s | 0 | 20 | 40 | 60] | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L.s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$.
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.(多选)
A.N2O4的转化率越高B.NO2的产量越大
C.N2O4与NO2的浓度之比越大D.正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4起始浓度B.向混合气体中通入NO2C.使用高效催化剂D.升高温度
(6)当反应达到平衡后,下列操作,不能使平衡混合气体颜色加深的是D
A.恒温恒容下再通入N2O4气体
B.恒温恒容下再通入NO2气体
C.恒容时,升高温度
D.恒温恒容时通入Ar
E.恒温时压缩体积.
6.在100℃时,将0.10mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格数据:
试填空:
(1)该反应的化学方程式为N2O4?2 NO2,达到平衡时N2O4的转化率为60%,表中c2>c3,a=b(填“>”、“<”或“=”).
(2)20s时,N2O4的浓度c1=0.07mol/L,在0~20s内N2O4的平均反应速率为0.0015mol•(L•s)-1.
(3)若在相同情况下最初向该容器中充入的是NO2气体,则要达到上述同样的平衡状态,NO2的起始浓度是0.2mol/L.
| 时间/s 浓度(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.10 | c1 | 0.05 | c3 | a | b |
| c(NO2) | 0.00 | 0.06 | c2 | 0.12 | 0.12 | 0.12 |
(1)该反应的化学方程式为N2O4?2 NO2,达到平衡时N2O4的转化率为60%,表中c2>c3,a=b(填“>”、“<”或“=”).
(2)20s时,N2O4的浓度c1=0.07mol/L,在0~20s内N2O4的平均反应速率为0.0015mol•(L•s)-1.
(3)若在相同情况下最初向该容器中充入的是NO2气体,则要达到上述同样的平衡状态,NO2的起始浓度是0.2mol/L.
4.已知热化学方程式:2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1,则关于热化学方程式:2H2O(l)═2H2(g)+O2(g)△H2=?的说法中正确的是( )
| A. | 热化学方程式中化学计量数表示分子数 | |
| B. | 该反应△H2>0 | |
| C. | 该反应的△H2=-571.6 kJ•mol-1 | |
| D. | 该反应可表示36 g水分解时的热效应 |
2.某温度下,反应2SO2(g)+O2(g)═2SO3 (g) 的平衡常数K1=25,在同一温度下,反应SO3(g)═SO2(g)+$\frac{1}{2}$O2(g)的平衡常数K2的值为( )
0 173322 173330 173336 173340 173346 173348 173352 173358 173360 173366 173372 173376 173378 173382 173388 173390 173396 173400 173402 173406 173408 173412 173414 173416 173417 173418 173420 173421 173422 173424 173426 173430 173432 173436 173438 173442 173448 173450 173456 173460 173462 173466 173472 173478 173480 173486 173490 173492 173498 173502 173508 173516 203614
| A. | 50 | B. | 5 | C. | 0.2 | D. | 0.01 |
 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.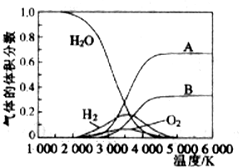 下列各种说法或表述正确的是⑤⑥.
下列各种说法或表述正确的是⑤⑥.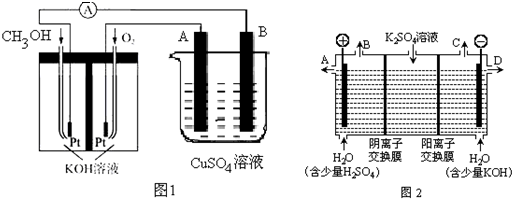
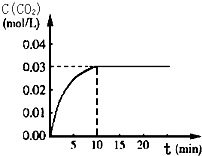 K增大的有A(填字母)
K增大的有A(填字母)