7.根据有关化学原理,下列判断正确的是( )
| A. | 常温下,弱酸A的浓度小于弱酸B,则A的电离程度一定大于B | |
| B. | 晶体A易溶于CCl4则A一定是分子晶体 | |
| C. | 在溶液中单质A能置换出金属B,则单质A可以是金属也可以是非金属 | |
| D. | 能量低的状态更稳定,则自然界的物质都以能量最低的状态存在 |
5.如图实验装置或对实验现象的描述正确的是( )
| A. |  分馏装置 | B. | 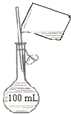 配制150 mL 0.10 mol•L-1盐酸 | ||
| C. |  烧瓶内溶液变蓝色 | D. |  出现砖红色沉淀 |
3.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )?
| A. | 常温常压下,48g O3含有的氧原子数为3NA? | |
| B. | 1.8g的NH${\;}_{4}^{+}$中含有的电子数为0.1NA | |
| C. | 常温常压下,8 g氧气所含的原子数为NA | |
| D. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA |
2.1000K时反应 C(s)+2H2(g)?CH4(g)的K=0.5,当各气体物质的量浓度分别为H2 0.7mol•L-1、CH4 0.2mol•L-1时,上述反应( )
| A. | 正向移动 | B. | 逆向移动 | C. | 达到平衡 | D. | 不一定 |
1.质量分别为64g的SO2和O2混合后,按2SO2(g)+O2(g)?2SO3(g)△H=-Q(Q>0)kJ/mol,在一定条件下的绝热恒容(假设VL)容器中达到平衡,下列说法正确的是( )
| A. | O2的转化率比SO2的更大 | |
| B. | 达平衡时共转移的电子数一定小于NA | |
| C. | 达平衡时共放出热量小于$\frac{Q}{2}$kJ | |
| D. | 可由反应前后压强变化确定平衡常数 |
20.下列说法正确的是( )
| A. | 升高温度均可以使氨水、氯化铵溶液中c(NH4+)增大 | |
| B. | H2O是一种弱电解质 | |
| C. | 用托盘天平称量NaOH固体时,需在左右托盘上各方一块质量相等的滤纸 | |
| D. | 用25mL滴定管量取25.00mLNaOH溶液时,需将调好零点的滴定管中所有液体放出 |
19.800℃时,在2L密闭容器内充入0.50mol NO和0.25mol O2,发生如下反应:2NO(g)+O2(g)?2NO2(g)△H<0.体系中n( NO)随时间的变化如表:
(1)能说明该反应已达到平衡状态的是BCD
A.υ(NO2)正=υ(O2)逆 B.容器内压强保持不变
C.υ(NO)逆=2υ( O2)正 D.容器内气体颜色不变
(2)能使该反应的平衡向正反应方向移动的措施是BC
A.适当升高温度 B.缩小反应容器的体积
C.增大O2的浓度 D.选择高效催化剂.
0 173194 173202 173208 173212 173218 173220 173224 173230 173232 173238 173244 173248 173250 173254 173260 173262 173268 173272 173274 173278 173280 173284 173286 173288 173289 173290 173292 173293 173294 173296 173298 173302 173304 173308 173310 173314 173320 173322 173328 173332 173334 173338 173344 173350 173352 173358 173362 173364 173370 173374 173380 173388 203614
| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.50 | 0.35 | 0.28 | 0.25 | 0.25 | 0.25 |
A.υ(NO2)正=υ(O2)逆 B.容器内压强保持不变
C.υ(NO)逆=2υ( O2)正 D.容器内气体颜色不变
(2)能使该反应的平衡向正反应方向移动的措施是BC
A.适当升高温度 B.缩小反应容器的体积
C.增大O2的浓度 D.选择高效催化剂.