12.工业上常利用含硫废水生产海波Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.
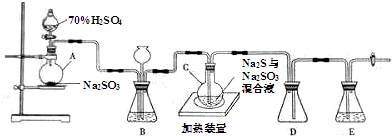
烧瓶C中发生反应如下:
①Na2S+H2O+SO2═Na2SO3+H2S
②2H2S+SO2═3S+2H2O
③S+Na2SO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱液面不下降,则整个装置气密性良好.
(2)为提高产品纯度,应使烧瓶C中Na2SO3和Na2S恰好完全反应,则烧瓶C中Na2SO3和Na2S物质的量之比为1﹕2.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择c.
a.饱和NaOH溶液 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d. 高锰酸钾溶液
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质.已知Na2S2O3•5H2O遇酸易分解:S2O${\;}_{3}^{2-}$+2H+═S↓+SO2↑+H2O.利用所给试剂(稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)设计实验,检测产品中是否存在Na2SO4.简要说明实验操作,现象和结论:取样,溶于水配成溶液,加入足量稀盐酸至无气泡产生,在上层清液中滴入BaCl2溶液,若有沉淀生成,则存在Na2SO4.
(5)为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶 液25mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出.
测得有关实验数据如下(标准状况):
所用硫酸溶液中溶质的物质的量浓度为4mol/L.(写出计算过程)

烧瓶C中发生反应如下:
①Na2S+H2O+SO2═Na2SO3+H2S
②2H2S+SO2═3S+2H2O
③S+Na2SO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱液面不下降,则整个装置气密性良好.
(2)为提高产品纯度,应使烧瓶C中Na2SO3和Na2S恰好完全反应,则烧瓶C中Na2SO3和Na2S物质的量之比为1﹕2.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择c.
a.饱和NaOH溶液 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d. 高锰酸钾溶液
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质.已知Na2S2O3•5H2O遇酸易分解:S2O${\;}_{3}^{2-}$+2H+═S↓+SO2↑+H2O.利用所给试剂(稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)设计实验,检测产品中是否存在Na2SO4.简要说明实验操作,现象和结论:取样,溶于水配成溶液,加入足量稀盐酸至无气泡产生,在上层清液中滴入BaCl2溶液,若有沉淀生成,则存在Na2SO4.
(5)为了测定某海波样品的成分,称取三份质量不同的该样品,分别加入相同浓度的硫酸溶 液25mL,充分反应后滤出硫,微热滤液使生成的SO2全部逸出.
测得有关实验数据如下(标准状况):
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.00 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
7.下列物质属于碱的是( )
0 173071 173079 173085 173089 173095 173097 173101 173107 173109 173115 173121 173125 173127 173131 173137 173139 173145 173149 173151 173155 173157 173161 173163 173165 173166 173167 173169 173170 173171 173173 173175 173179 173181 173185 173187 173191 173197 173199 173205 173209 173211 173215 173221 173227 173229 173235 173239 173241 173247 173251 173257 173265 203614
| A. | Na2CO3 | B. | Na2O | C. | NaCl | D. | NaOH |
 ;
;
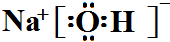 ;
; 防治环境污染,改善生态环境已成为全球共识.
防治环境污染,改善生态环境已成为全球共识. 营养平衡、合理用药是保证人体健康和生活质量的重要途径.
营养平衡、合理用药是保证人体健康和生活质量的重要途径.