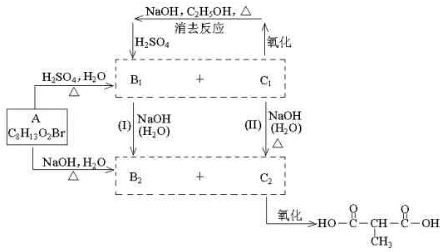
11.在标准状况下进行甲、乙、丙三组实验.三组实验均各取30mL 1mol•L-1盐酸,加入同一种镁铝合金粉末,产生气体,有关数据见下表:
(1)甲组中反应的离子方程式为Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑.
(2)乙组中盐酸不足(填“足量”或“不足量”).
(3)Mg、Al物质的量之比为1:1.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(2)乙组中盐酸不足(填“足量”或“不足量”).
(3)Mg、Al物质的量之比为1:1.
10.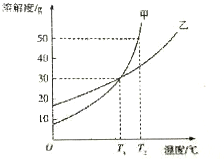 甲、乙两物质的溶解度曲线细图所示,假设溶液的密度为pg•cm-3,溶质的摩尔质量为Mg•mol-1,溶质的物质的量浓度为cmol•L-1,则下列叙述正确的是( )
甲、乙两物质的溶解度曲线细图所示,假设溶液的密度为pg•cm-3,溶质的摩尔质量为Mg•mol-1,溶质的物质的量浓度为cmol•L-1,则下列叙述正确的是( )
 甲、乙两物质的溶解度曲线细图所示,假设溶液的密度为pg•cm-3,溶质的摩尔质量为Mg•mol-1,溶质的物质的量浓度为cmol•L-1,则下列叙述正确的是( )
甲、乙两物质的溶解度曲线细图所示,假设溶液的密度为pg•cm-3,溶质的摩尔质量为Mg•mol-1,溶质的物质的量浓度为cmol•L-1,则下列叙述正确的是( )| A. | T1℃时,甲、乙饱和溶液的物质的量浓度一定相等 | |
| B. | T1℃和T2℃时,甲的饱和溶液的质量分数之比为9:13 | |
| C. | T1℃时,在100g水中加入60g乙,则c(乙)=$\frac{1000×ρ(乙)×37.5%}{M(乙)}$ | |
| D. | T1℃和T2℃时,甲的饱和溶液的物质的量浓度之比为9:13 |
9.在80℃时,水的离子积为1.6×10-13,若该温度下某溶液中的c(H+)为1×10-7mol/L,则该溶液( )
| A. | 呈碱性 | B. | 呈酸性 | C. | 呈中性 | D. | c(OH-)=10c(H+) |
8.下列表述正确的是( )
| A. | 某离子第三层上和第二层上的电子数均为第一层的4倍 | |
| B. | Cl-的结构示意图: | |
| C. | 某物质的焰色反应为黄色,某物质一定为钠的化合物 | |
| D. | 14C和14N的质量数相等,互称为同位素 |
5.在酸性高锰酸钾溶液中加入过氧化钠粉末,溶液褪色,其中发生反应的离子方程式为:2MnO${\;}_{4}^{-}$+16H++5Na2O2═2Mn2++5O2↑+8H2O+10Na+.下列判断正确的是( )
| A. | O2是还原产物,Mn2+是氧化产物 | |
| B. | Na2O2既是氧化剂,又是还原剂 | |
| C. | 标准状况下,产生22.4L O2时反应转移2mol e- | |
| D. | 通常用浓盐酸酸化高锰酸钾溶液 |
4.下列与含氯化合物有关的说法正确的是( )
0 172986 172994 173000 173004 173010 173012 173016 173022 173024 173030 173036 173040 173042 173046 173052 173054 173060 173064 173066 173070 173072 173076 173078 173080 173081 173082 173084 173085 173086 173088 173090 173094 173096 173100 173102 173106 173112 173114 173120 173124 173126 173130 173136 173142 173144 173150 173154 173156 173162 173166 173172 173180 203614
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| C. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| D. | 电解NaCl溶液得到22.4L H2(标准状况),理论上需要转移NA个电子 |