17. 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
(1)二氧化碳重整可用于制取甲烷.已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
则反应CO2(g)+4H2(g)?CH4(g)+2H2(g)的△H3-163kJ/mol.
(2)一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向正反应方向移动.
②在700K、起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,H2的转化率为40%.若达到平衡后H2的浓度为amol•L-1,则达到平衡时CH2CH2OH的浓度为$\frac{a}{9}$mol/L.
(3)CO2和H2在一定条件下可合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+2H2O(g)△H.在一定压强下,将2.5molH2与amolCO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据如下表:
①x、y的大小关系为B.
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0 B.该反应的平衡常数随温度升高而减小
C.转化率分别为z、w时,达到平衡的时间前者长 D.转化率分别为y、w时,平衡常数不同.
 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷.已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
则反应CO2(g)+4H2(g)?CH4(g)+2H2(g)的△H3-163kJ/mol.
(2)一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向正反应方向移动.
②在700K、起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,H2的转化率为40%.若达到平衡后H2的浓度为amol•L-1,则达到平衡时CH2CH2OH的浓度为$\frac{a}{9}$mol/L.
(3)CO2和H2在一定条件下可合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+2H2O(g)△H.在一定压强下,将2.5molH2与amolCO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据如下表:
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0 B.该反应的平衡常数随温度升高而减小
C.转化率分别为z、w时,达到平衡的时间前者长 D.转化率分别为y、w时,平衡常数不同.
15. 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
则反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的△H3=-163kJ/mol.
(2)一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向逆反应 方向移动.
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,H2 的转化率为40%.
(3)CO2和H2在一定条件下可合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H.在一定压强下,将2.5molH2与a molCO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据如下表:
①x、y的大小关系为B.
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应叙述正确的是ABC
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z、w时,达到平衡的时间前者长
D.转化率分别为y、w时,平衡常数不同.
 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247kJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205kJ•mol-1
则反应CO2(g)+4H2(g)?CH4(g)+2H2O(g)的△H3=-163kJ/mol.
(2)一定压强下,在某恒容密闭容器中,充入H2和CO2发生反应:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向逆反应 方向移动.
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,H2 的转化率为40%.
(3)CO2和H2在一定条件下可合成二甲醚:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H.在一定压强下,将2.5molH2与a molCO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据如下表:
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应叙述正确的是ABC
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z、w时,达到平衡的时间前者长
D.转化率分别为y、w时,平衡常数不同.
14.t℃时,在2L密闭、恒压容器中充入1molA和1molB,发生反应:A(g)+B(g)?C(g). 5min后达到平衡,测得C的物质的量分数为60%,则下列说法正确的是( )
| A. | 5min内平均反应速率vA=0.15mol•L-1•min-1 | |
| B. | 当同时对原平衡体系升高一定温度和增加一定压强时,达平衡后,C的物质的量分数为60%,则该反应的正反应为放热反应 | |
| C. | 保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,则反应将向逆反应方向进行 | |
| D. | t℃,向2L密闭、恒容容器中加入等物质的量的A和B,反应达到平衡状态时,C的物质的量分数仍为60%,则加入A的物质的量为1.6mol |
13.甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一.回答下列问题:
(1)工业上可用CO2和H2反应合成甲醇.已知25℃、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ/mol-1
CH2OH(g)+$\frac{3}{2}$O2═CO2(g)+2H2O(g) )△H2=-676kJ/mol-1
①写出CO2与H2反应生成CH2OH与H2O(g)的热化学方程式:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
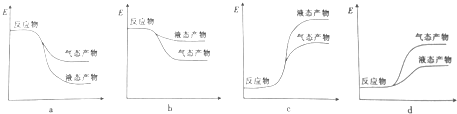
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母).
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
①x=0.14,250℃时该反应的平衡常数K=46.3.
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
(3)CH3OH在催化剂条件下可以被直接氧化成HCOOH.在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度HCOOH溶液混合后所得溶液中各离子浓度大小关系为c(Na+)>c(HCOO-)>c(OH-)>c(H+).
(1)工业上可用CO2和H2反应合成甲醇.已知25℃、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ/mol-1
CH2OH(g)+$\frac{3}{2}$O2═CO2(g)+2H2O(g) )△H2=-676kJ/mol-1
①写出CO2与H2反应生成CH2OH与H2O(g)的热化学方程式:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母).

③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
(3)CH3OH在催化剂条件下可以被直接氧化成HCOOH.在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度HCOOH溶液混合后所得溶液中各离子浓度大小关系为c(Na+)>c(HCOO-)>c(OH-)>c(H+).
10.已知:A(g)+B(g)?C(g)+D(g)△H=-41kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
下列说法中,不正确的是( )
0 172153 172161 172167 172171 172177 172179 172183 172189 172191 172197 172203 172207 172209 172213 172219 172221 172227 172231 172233 172237 172239 172243 172245 172247 172248 172249 172251 172252 172253 172255 172257 172261 172263 172267 172269 172273 172279 172281 172287 172291 172293 172297 172303 172309 172311 172317 172321 172323 172329 172333 172339 172347 203614
| 容器编号 | 起始时各种物质的量/mol | 达到平衡时体系能量的变化 | |||
| n(A) | n(B) | n(C) | n(D) | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
| ② | 0 | 0 | 1 | 4 | 放出热量:Q1 |
| ③ | 1 | 1 | 2 | 1 | 放出热量:Q2 |
| A. | 若容器①中反应10min达到平衡,0~10min时间内,用A表示的平均反应速率v(A)=4.0×10-2mol/(L•min) | |
| B. | 平衡时,①与②容器中A的体积分数相等 | |
| C. | ③达平衡时体系能量的变化主要为热能转化为化学能 | |
| D. | 容器③中,开始时v(B)生成>v(B)消耗 |


 苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H
苯乙烯(C6H5CH=CH2)2是合成橡胶和塑料的单体,用来生产丁苯橡胶、聚苯乙烯等.工业上以乙苯C6H5CH2CH3为原料,采用催化脱氢的方法制取苯乙烯,反应方程式为:C6H5CH2CH3(g)?C6H5CH=CH2(g)+H2(g)△H 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收: