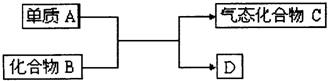
10.下列说法正确的是( )
| A. | 化学的特征是认识分子 | |
| B. | 新制氯水应保存在棕色试剂瓶中,放于阴凉处 | |
| C. | 在化学反应中,参加反应的各物质的质量比等于其物质的量之比 | |
| D. | 英国化学家玻义耳提出原子学说,为近代化学的发展奠定了坚实的基础 |
9.SO2的含量是空气质量日报中一项重要检测指标,请结合所学知识回答下列问题.
(1)工业制硫酸过程中,SO2催化氧化的原理为:
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)
T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图1所示.
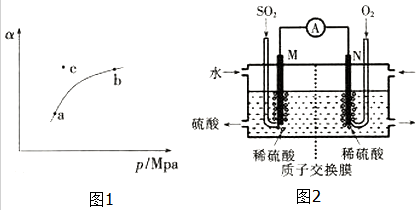
①a、b两点对应的平衡常数K(a)=K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a)>c(b).
②c点时,反应速率v(正)<v(逆).
(2)电化学法处理SO2.
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图2所示(电极均为惰性材料):
①M极发生的电极反应式为SO2-2e-+2H2O=4H++SO42-.
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为0.014L(已知:1个e-所带电量为1.6×10-19C).
(3)溶液法处理SO2.
已知常温下H2SO3和H2CO3的电离常数如表所示:
常温下,将SO2缓慢通入100mL 0.2mol•L-1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为SO2+H2O+CO32-=HCO3-+HSO3-;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
(1)工业制硫酸过程中,SO2催化氧化的原理为:
2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)
T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图1所示.

①a、b两点对应的平衡常数K(a)=K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a)>c(b).
②c点时,反应速率v(正)<v(逆).
(2)电化学法处理SO2.
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图2所示(电极均为惰性材料):
①M极发生的电极反应式为SO2-2e-+2H2O=4H++SO42-.
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为0.014L(已知:1个e-所带电量为1.6×10-19C).
(3)溶液法处理SO2.
已知常温下H2SO3和H2CO3的电离常数如表所示:
| 电离常数 酸 | K1 | K2 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
4.下列说法错误的是( )
| A. | 实验室中少量金属钠通常保存在煤油中 | |
| B. | 光线通过时,胶体可产生丁达尔效应 | |
| C. | 氧气、液氯是单质,氯水、氯化氢、纯碱是化合物. | |
| D. | “只要工夫深,铁杵磨成针”只涉及物理变化 |
1.A、B、C三种元素的核电荷数都小于18,A元素的原子最外层电子数是1,B元素原子的最外层得到1个电子就达到稳定结构,C元素原子最外层电子数是次外层电子数的3倍,则这三种元素组成的化合物不可能的是( )
0 171993 172001 172007 172011 172017 172019 172023 172029 172031 172037 172043 172047 172049 172053 172059 172061 172067 172071 172073 172077 172079 172083 172085 172087 172088 172089 172091 172092 172093 172095 172097 172101 172103 172107 172109 172113 172119 172121 172127 172131 172133 172137 172143 172149 172151 172157 172161 172163 172169 172173 172179 172187 203614
| A. | A2BC3 | B. | ABC3 | C. | ABC4 | D. | ABC |