16.在固定容积的密闭容器中,反应2X?Y(g)+Z(s)已达到平衡,此时升高温度则气体混合物的密度增大,下列叙述正确的是( )
| A. | 若X为非气态,则正反应为放热反应 | |
| B. | 若正反应为放热反应,则X为气态 | |
| C. | 在平衡混合物中加入少量Z(s),则平衡向左移动 | |
| D. | 压强变化对该平衡没有影响 |
12.下列化学反应中,不属于四种基本反应类型的是( )
| A. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | |
| B. | NH3+HCl═NH4Cl | |
| C. | Ba(OH)2+MgSO4═BaSO4↓+Mg(OH)2↓ | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
11.下列化学反应中,不属于氧化还原反应( )
| A. | 2H2O2 $\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | B. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | Cl2+H2O═HCl+HClO |
10.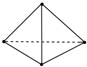 最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )
 最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N键吸收167kJ热量,生成1mol N≡N键放出942kJ热量.根据以上信息和数据,则1mol N4生成N2的△H为( )| A. | +882 kJ•mol-1 | B. | +441 kJ•mol-1 | C. | -882 kJ•mol-1 | D. | -441 kJ•mol-1 |
8.某校化学课外研究小组为研究浓硫酸与金属M 反应的气体生成物,进行了下列实验活动:
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3:气体生成物是SO2和H2的混合气体.
【实验验证】
实验装置及实验中使用的试剂如图:
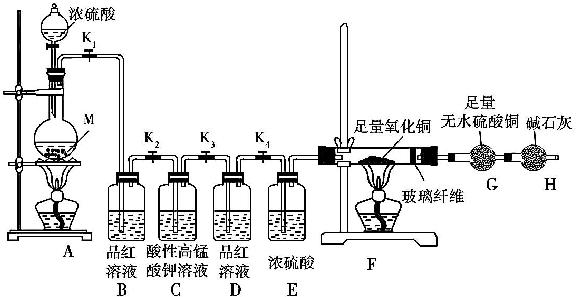
(1)在装入药品前,甲同学检查装置A的气密性,方法是关闭弹簧夹K1,打开分液漏斗活塞,向分液漏斗中注入适量水,若分液漏斗滴下水的速度逐渐变慢,直至停止,则证明装置A的气密性良好.
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设2,理由是浓硫酸具有强氧化性,在加热的条件下能被金属还原为SO2.
(3)如果实验中观察到装置B 中溶液褪色,装置F 和装置G 中无明显变化,则假设1成立,实验测得消耗金属M 和浓硫酸的物质的量之比为1:2,则在M的硫酸盐中,M元素的化合价为+2
(4)如果假设3正确,填写下表中的实验现象:
(5)装置C的作用是除去可能未反应完的SO2,装置D 的作用是检验SO2是否已除净.
(6)如果装置A中放入的金属M 的质量为11.2g,加入适量浓硫酸,反应完成后,装置B 中溶液褪色,装置A 中金属无剩余;反应后G的质量增加了0.9g;取少量装置A 中溶液稀释,分为两份,一份滴加KSCN 溶液,溶液变红色,另一份滴加酸性KMnO4 溶液,溶液褪色.如果装置A中溶液内的金属离子浓度相等,则装置A 中烧瓶内发生反应的总化学方程式是4Fe+9H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2FeSO4+Fe2(SO4)3+4SO2↑+H2↑+8H2O.
【提出假设】
假设1:气体生成物只有SO2;
假设2:气体生成物只有H2;
假设3:气体生成物是SO2和H2的混合气体.
【实验验证】
实验装置及实验中使用的试剂如图:

(1)在装入药品前,甲同学检查装置A的气密性,方法是关闭弹簧夹K1,打开分液漏斗活塞,向分液漏斗中注入适量水,若分液漏斗滴下水的速度逐渐变慢,直至停止,则证明装置A的气密性良好.
(2)乙同学通过所学知识排除了上面提出的一个假设,他排除的是假设2,理由是浓硫酸具有强氧化性,在加热的条件下能被金属还原为SO2.
(3)如果实验中观察到装置B 中溶液褪色,装置F 和装置G 中无明显变化,则假设1成立,实验测得消耗金属M 和浓硫酸的物质的量之比为1:2,则在M的硫酸盐中,M元素的化合价为+2
(4)如果假设3正确,填写下表中的实验现象:
| 装置 | B | F | G |
| 实验现象 | |||
(6)如果装置A中放入的金属M 的质量为11.2g,加入适量浓硫酸,反应完成后,装置B 中溶液褪色,装置A 中金属无剩余;反应后G的质量增加了0.9g;取少量装置A 中溶液稀释,分为两份,一份滴加KSCN 溶液,溶液变红色,另一份滴加酸性KMnO4 溶液,溶液褪色.如果装置A中溶液内的金属离子浓度相等,则装置A 中烧瓶内发生反应的总化学方程式是4Fe+9H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2FeSO4+Fe2(SO4)3+4SO2↑+H2↑+8H2O.
7.一定温度下,在体积可变的恒温密闭容器中,甲醇在浓硫酸作催化剂的条件下发生下列反应:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1,下列有关该反应的叙述正确的是( )
0 171960 171968 171974 171978 171984 171986 171990 171996 171998 172004 172010 172014 172016 172020 172026 172028 172034 172038 172040 172044 172046 172050 172052 172054 172055 172056 172058 172059 172060 172062 172064 172068 172070 172074 172076 172080 172086 172088 172094 172098 172100 172104 172110 172116 172118 172124 172128 172130 172136 172140 172146 172154 203614
| A. | 该条件下,1 mol CH3OH(g)参加反应,放出的热量为25 kJ | |
| B. | 若不采用合适的催化剂,该反应中甲醇的转化率将降低 | |
| C. | 升高温度和增大压强(缩小容器容积)均可加快反应速率 | |
| D. | 反应过程中,2v(CH3OH)=v(CH3OCH3) |