4.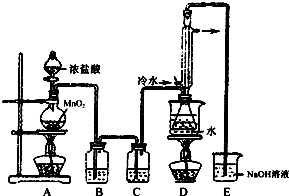 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
①CS2+3Cl2$\frac{\underline{\;95~100℃\;}}{\;}$CCl4+S2Cl2;
②2S+Cl2$\frac{\underline{\;111~140℃\;}}{\;}$S2Cl2.
已知:S2Cl2易与水反应,S2Cl2+Cl2$\stackrel{△}{?}$2SCl2.
下列是几种物质的熔沸点和反应装置图
(1)利用如图装置(部分夹持仪器已略去)来制备S2Cl2,反应原理是①(填写以上两种反应原理的数字序号).
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是无水氯化钙或五氧化二磷.
(3)D装置中冷凝管的作用是冷凝回流、导气;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是蒸馏.
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不能太快.
(6)图中尾部装置不够完善,存在的问题是在D和E之间增加干燥装置,同时尾气吸收要防倒吸.
 S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:
S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的反应原理有两种:①CS2+3Cl2$\frac{\underline{\;95~100℃\;}}{\;}$CCl4+S2Cl2;
②2S+Cl2$\frac{\underline{\;111~140℃\;}}{\;}$S2Cl2.
已知:S2Cl2易与水反应,S2Cl2+Cl2$\stackrel{△}{?}$2SCl2.
下列是几种物质的熔沸点和反应装置图
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
(2)若装置C更换成干燥管,则装置C中可选用的固体试剂是无水氯化钙或五氧化二磷.
(3)D装置中冷凝管的作用是冷凝回流、导气;反应结束后,将D装置锥形瓶内的混合物中分离出产物的方法是蒸馏.
(4)S2Cl2与足量水反应有黄色沉淀生成,产生的无色气体能使品红溶液褪色,则该反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(5)为了提高制得的产品S2Cl2的纯度,关键的操作是控制好温度和控制浓盐酸的滴速不能太快.
(6)图中尾部装置不够完善,存在的问题是在D和E之间增加干燥装置,同时尾气吸收要防倒吸.
2.某溶液中有NH4+、Mg2+、Cu2+,Fe3+四种阳离子,加入过量NaOH溶液,微热并搅拌,再加入足量盐酸,溶液中大量减少的阳离子是( )
| A. | NH4+ | B. | Mg2+ | C. | Cu2+ | D. | Fe3+ |
1.下列有关实验现象描述正确的是( )
| A. | 将Fe(OH)3和水充分搅拌,滴加酚酞试液溶液变红色 | |
| B. | 在FeCl3溶液中滴加KSCN溶液,产生血红色沉淀 | |
| C. | 在酸性FeSO4溶液中滴加KMnO4 溶液至反应完全,溶液呈无色 | |
| D. | 在FeCl3溶液中加入铜粉能溶解 |
20.生物学家借助新的显微技术,成功观察到小于200nm的微粒,下列分散系中,分散质微粒半径最小的是( )
| A. | 向CuSO4溶液中加入NaOH溶液得到的分散系 | |
| B. | 向水中加入食盐得到的分散系 | |
| C. | 向沸水中滴入FeCl3饱和溶液得到的红褐色液体 | |
| D. | 向澄清的石灰水中通入少量二氧化碳气体得到的分散系 |
17.和氢硫酸反应但不能产生沉淀的是( )
0 171849 171857 171863 171867 171873 171875 171879 171885 171887 171893 171899 171903 171905 171909 171915 171917 171923 171927 171929 171933 171935 171939 171941 171943 171944 171945 171947 171948 171949 171951 171953 171957 171959 171963 171965 171969 171975 171977 171983 171987 171989 171993 171999 172005 172007 172013 172017 172019 172025 172029 172035 172043 203614
| A. | 氯水 | B. | Na2S溶液 | C. | SO2 | D. | 稀H2SO4 | ||||
| E. | Fe3+ |

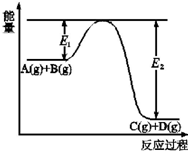 已知可逆反应A(g)+B(g)?C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题:
已知可逆反应A(g)+B(g)?C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题: