6.下列有机物中同分异构体数目最多的是( )
| A. | C8H10(芳香烃) | B. | 戊酸 | C. | C4H8Cl2 | D. | C4H8O2(酯) |
5.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在标准状况下,560 mL甲烷与甲醛组成的混合物中含有的共用电子对数为0.1 NA | |
| B. | 电解精炼铜时转移了6.02×1023个电子,阳极溶解32 g铜 | |
| C. | 2.24 LCO和2.8gN2组成的混合物中质子数为2.8 NA | |
| D. | 含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1×6.02×1023 |
4.有关下列实验的说法,错误的是( )
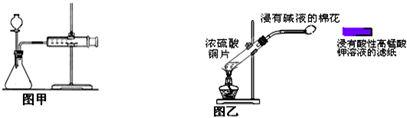

| A. | 硝酸钾制备实验中,将NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可以分离出硝酸钾 | |
| B. | 重结晶过程中产生的母液虽然含有杂质,但仍应将母液收集起来,进行适当处理,以提高产率 | |
| C. | 甲装置可用于某些化学反应速率的测定.该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处 | |
| D. | 乙装置可用来制取和检验二氧化硫气体漂白性,待滤纸颜色褪去后立即用浸有碱液的棉花堵住试管口 |
3.如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )
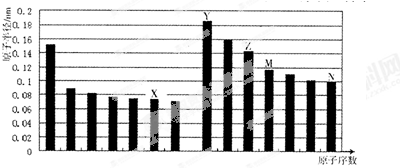

| A. | Z、N两种元素的离子半径相比,前者较大 | |
| B. | 工业上可通过电解熔融的Z 和N组成的化合物来制取Z单质 | |
| C. | 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应 | |
| D. | Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液 |
18.(1)镍氢碱性充电电池被誉为“绿色化学电源”,充、放电时的反应:2Ni(OH)2$?_{放电}^{充电}$2NiOOH+H2.放电时,正极的电极反应式为NiOOH+e-+H2O=Ni(OH)2+OH-,充电时,该电极应与电源的正(填“正”或“负”)极相连.
(2)氨在氧气中燃烧,生成水和氮气.已知:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1
2H2(g)+O2(g)=2H2O(l);△H=-572kJ•mol-1
则氨在氧气中燃烧生成液态水和氮气时的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1.
(3)研究表明工业上合成氨反应(N2+3H2$?_{高温高压}^{催化剂}$2NH3)在25℃、400℃的平衡常数分别为5×105和200.
①合成氨是放热反应(填“放热”或“吸热”).
②合成氨选择400~500℃的原因是:加快反应速率,催化剂活性最大.
③在容积固定的密闭容器中发生上述反应,如表中为各物质在不同时刻的浓度.
0~5min,H2的平均反应速率=0.072mol/(L•min).反应在5分钟时,条件发生了改变,改变的条件可能是a(填序号).
a.使用催化剂 b.降低温度 c.增加氢气的浓度 d.分离出NH3
(4)在-50℃时,液氨中存在电离平衡NH3(l)?NH4++NH2-,离子积常数K=c(NH+4)•c(NH2-).若一定条件下,平衡时c(NH2-)=1×10-15 mol•L-1,下列说法正确的是b.
a.在液氨中加入NaNH2,液氨的离子积常数增大b.此温度下液氨的离子积常数为1×10-30c.液氨在-50℃的电离程度比常温下纯水的大
(5)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是AB(填字母).
A.放电时负极反应为:Zn+2OH--2e-═Zn(OH)2
B.充电时阳极反应为:Fe(OH)3+5OH--3e-═FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化.
(2)氨在氧气中燃烧,生成水和氮气.已知:N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1
2H2(g)+O2(g)=2H2O(l);△H=-572kJ•mol-1
则氨在氧气中燃烧生成液态水和氮气时的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1.
(3)研究表明工业上合成氨反应(N2+3H2$?_{高温高压}^{催化剂}$2NH3)在25℃、400℃的平衡常数分别为5×105和200.
①合成氨是放热反应(填“放热”或“吸热”).
②合成氨选择400~500℃的原因是:加快反应速率,催化剂活性最大.
③在容积固定的密闭容器中发生上述反应,如表中为各物质在不同时刻的浓度.
| 时间/min | c(N2)/mol•L-1 | c(H2)/mol•L-1 | c(NH3)/mol•L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
a.使用催化剂 b.降低温度 c.增加氢气的浓度 d.分离出NH3
(4)在-50℃时,液氨中存在电离平衡NH3(l)?NH4++NH2-,离子积常数K=c(NH+4)•c(NH2-).若一定条件下,平衡时c(NH2-)=1×10-15 mol•L-1,下列说法正确的是b.
a.在液氨中加入NaNH2,液氨的离子积常数增大b.此温度下液氨的离子积常数为1×10-30c.液氨在-50℃的电离程度比常温下纯水的大
(5)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是AB(填字母).
A.放电时负极反应为:Zn+2OH--2e-═Zn(OH)2
B.充电时阳极反应为:Fe(OH)3+5OH--3e-═FeO42-+4H2O
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化.
17.下面是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.

①高温煅烧时的反应原理为:Li2O•Al2O3•SiO2+K2SO4=K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4=Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
④Li2SO4、Li2CO3在不同温度下的溶解度(g/100g水)
(1)浸取时使用冷水的原因是Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率.
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+浓度和溶液温度,使得Li2CO3容易成淀.
(5)洗涤Li2CO3晶体使用热水.
0 171835 171843 171849 171853 171859 171861 171865 171871 171873 171879 171885 171889 171891 171895 171901 171903 171909 171913 171915 171919 171921 171925 171927 171929 171930 171931 171933 171934 171935 171937 171939 171943 171945 171949 171951 171955 171961 171963 171969 171973 171975 171979 171985 171991 171993 171999 172003 172005 172011 172015 172021 172029 203614

①高温煅烧时的反应原理为:Li2O•Al2O3•SiO2+K2SO4=K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4=Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10 | 20 | 50 | 80 |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+浓度和溶液温度,使得Li2CO3容易成淀.
(5)洗涤Li2CO3晶体使用热水.
 ;
; (1)COC12俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为
(1)COC12俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为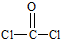 ,其中碳氧原子之间共价键是c(填序号).
,其中碳氧原子之间共价键是c(填序号).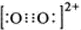 .
.