13.(1)已知某些化学键的键能数据如表:
则反应CH4 (g)+2O2(g)=CO2(g)+2H2O(g)的△H 为-(2e+4c-4b-2d)KJ/mol.
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
①用太阳能分解10mol液态水消耗的能量是2858kJ;
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
③在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为CH3OH+H2O-6e-=CO2+6H+.
| 化学键 | C-O | C-H | H-O | O=O | C=O | C-C |
| 键能/kJ•mol-1 | a | b | c | d | e | f |
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
①用太阳能分解10mol液态水消耗的能量是2858kJ;
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
③在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为CH3OH+H2O-6e-=CO2+6H+.
10.下列各组中化合物的性质比较,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性:SiH4>PH3>H2S | D. | 非金属性:F>O>S |
9.下列有关电解原理的说法正确的是( )
①电解质溶液中的阴离子移向电解池的阳极
②电解池的阳极发生还原反应
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理也不能实现
⑤任何溶液被电解时,必须导致氧化还原反应的发生.
①电解质溶液中的阴离子移向电解池的阳极
②电解池的阳极发生还原反应
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理也不能实现
⑤任何溶液被电解时,必须导致氧化还原反应的发生.
| A. | ①③⑤ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③④ |
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 与铝反应产生大量氢气的溶液:Na+、K+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ | |
| B. | c(H+)=1.0×10-13mol/L溶液中:CH3COO-、K+、SO${\;}_{4}^{2-}$、Br- | |
| C. | 饱和氯水中:Cl-、NO${\;}_{3}^{-}$、Na+、SO${\;}_{3}^{2-}$ | |
| D. | 水电离出的c(H+)=1×10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO${\;}_{4}^{2-}$ |
4.NA表示阿伏伽德罗常数.下列判断正确的是( )
0 171753 171761 171767 171771 171777 171779 171783 171789 171791 171797 171803 171807 171809 171813 171819 171821 171827 171831 171833 171837 171839 171843 171845 171847 171848 171849 171851 171852 171853 171855 171857 171861 171863 171867 171869 171873 171879 171881 171887 171891 171893 171897 171903 171909 171911 171917 171921 171923 171929 171933 171939 171947 203614
| A. | 1mol氯气参加反应转移的电子数一定为2NA | |
| B. | 常温下10LpH=13的NaOH溶液中含有的OH-数目约为NA | |
| C. | 将0.1mol氯化铁溶于1L水中,所得溶液含有Fe3+数目为0.1NA | |
| D. | 电解法精炼铜时,当阳极有64g铜溶解,导线上流过电子数目为2NA |
 ,⑦的结构式H-O-Cl.
,⑦的结构式H-O-Cl. (1)观察图A、B、C,回答下列问题:
(1)观察图A、B、C,回答下列问题:
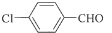 ;
; +3NaOH$\stackrel{高温高压}{→}$
+3NaOH$\stackrel{高温高压}{→}$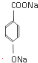 +NaCl+2H2O;
+NaCl+2H2O;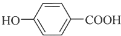 +(CH3)3COH $→_{△}^{浓H_{2}SO_{4}}$
+(CH3)3COH $→_{△}^{浓H_{2}SO_{4}}$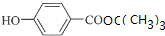 +H2O;
+H2O;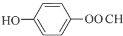 (任写一种结构简式).
(任写一种结构简式).