10.蛇纹石是一种富镁硅酸盐矿物的总称,因其颜色青绿相间酷似蛇皮而得名.蛇纹石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2组成.工业上由蛇纹石制取碱式碳酸镁产品的流程如下:
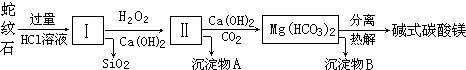
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是Fe3+、Fe2+.
(2)向Ⅰ中加入H2O2的作用是将Fe2+氧化成Fe3+或将Fe(OH)2氧化成Fe(OH)3,有关离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O,加入Ca(OH)2时,需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表).
若pH>8可能导致的后果Al(OH)3溶解、Mg2+沉淀.
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入NaOH溶液,然后过滤、洗涤、(干燥)灼烧(填写实验操作名称),即可获得红色颜料,实现废物的综合利用.
(4)若产品的化学式用aMgCO3•bMg(OH)2•cH2O表示,现称取18.2g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0g MgO,通过计算确定产品的化学式中:a=3,b=1,c=3.

(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是Fe3+、Fe2+.
(2)向Ⅰ中加入H2O2的作用是将Fe2+氧化成Fe3+或将Fe(OH)2氧化成Fe(OH)3,有关离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O,加入Ca(OH)2时,需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表).
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入NaOH溶液,然后过滤、洗涤、(干燥)灼烧(填写实验操作名称),即可获得红色颜料,实现废物的综合利用.
(4)若产品的化学式用aMgCO3•bMg(OH)2•cH2O表示,现称取18.2g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0g MgO,通过计算确定产品的化学式中:a=3,b=1,c=3.
9.环己酮是一种重要的有机化工原料,主要用于制造己内酰胺和己二酸.
 +Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$
+Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$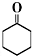 +H2O
+H2O
实验室可用环己醇氧化制取环己酮(已知该反应为放热反应):环己醇、环己酮和水的部分物理性质见下表:
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
实验步骤如下:

①将重铬酸钠溶于适量水,边搅拌边慢慢加入浓H2SO4,将所得溶液冷至室温备用.
②在一圆底烧瓶(乙)中加入适量环己醇,并将①中溶液分三次加入圆底烧瓶,每加一次都应振摇混匀.
控制瓶内温度在55℃~60℃之间,充分反应0.5h.
③向②反应后的圆底烧瓶内加入少量水,并接入图所示装置中,将T形管的活塞K打开,甲瓶中有适量水,加热甲,至有大量水蒸气冲出时,关闭K,同时接通冷凝水.
④将步骤③锥形瓶中收集到的液体经过以下一系列操作可得纯净的环己酮:a、蒸馏,除去乙醚后,收集151℃~155℃馏分;b、水层用乙醚(乙醚沸点34.6℃,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸)萃取,萃取液并入有机层;c、过滤;d、往液体中加入NaCl 固体至饱和,静置,分液; e、加入无水MgSO4固体.根据以上步骤回答下列问题:
(1)步骤①所得溶液分三次加入环己醇的原因是环己醇氧化为环己酮为放热反应,防止温度过高副反应增多.
(2)步骤③利用图示装置进行实验的目的是蒸馏出产品环已酮,实验过程中要经常检查甲中玻管内的水位.若玻管内的水位升高过多,其可能原因是系统有堵塞现象,此时应立即采取的措施是打开止水夹K(让水蒸汽发生器和大气相通).
(3)步骤④中操作的正确顺序是d b e c a,上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需漏斗、分液漏斗,在上述操作d中加入NaCl 固体的作用是增加水层的密度,有利于分层,e中加入无水MgSO4的作用是干燥剂,蒸馏除乙醚的过程中采用的加热方式为水浴加热.
(4)写出该实验中可能发生的一个副反应的化学方程式 .
.
 +Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$
+Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$ +H2O
+H2O实验室可用环己醇氧化制取环己酮(已知该反应为放热反应):环己醇、环己酮和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水和醚 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水,能溶于醚 |
| 水 | 100.0 | 0.9982 |
实验步骤如下:

①将重铬酸钠溶于适量水,边搅拌边慢慢加入浓H2SO4,将所得溶液冷至室温备用.
②在一圆底烧瓶(乙)中加入适量环己醇,并将①中溶液分三次加入圆底烧瓶,每加一次都应振摇混匀.
控制瓶内温度在55℃~60℃之间,充分反应0.5h.
③向②反应后的圆底烧瓶内加入少量水,并接入图所示装置中,将T形管的活塞K打开,甲瓶中有适量水,加热甲,至有大量水蒸气冲出时,关闭K,同时接通冷凝水.
④将步骤③锥形瓶中收集到的液体经过以下一系列操作可得纯净的环己酮:a、蒸馏,除去乙醚后,收集151℃~155℃馏分;b、水层用乙醚(乙醚沸点34.6℃,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸)萃取,萃取液并入有机层;c、过滤;d、往液体中加入NaCl 固体至饱和,静置,分液; e、加入无水MgSO4固体.根据以上步骤回答下列问题:
(1)步骤①所得溶液分三次加入环己醇的原因是环己醇氧化为环己酮为放热反应,防止温度过高副反应增多.
(2)步骤③利用图示装置进行实验的目的是蒸馏出产品环已酮,实验过程中要经常检查甲中玻管内的水位.若玻管内的水位升高过多,其可能原因是系统有堵塞现象,此时应立即采取的措施是打开止水夹K(让水蒸汽发生器和大气相通).
(3)步骤④中操作的正确顺序是d b e c a,上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需漏斗、分液漏斗,在上述操作d中加入NaCl 固体的作用是增加水层的密度,有利于分层,e中加入无水MgSO4的作用是干燥剂,蒸馏除乙醚的过程中采用的加热方式为水浴加热.
(4)写出该实验中可能发生的一个副反应的化学方程式
 .
.
7.FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S.
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是在沉积的FeCl3固体下方加热
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)②⑤
(4)装置B中冷水浴的作用为冷却,使FeCl3沉积,便于收集产品,装置C的名称为干燥管;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:酸性KMnO4溶液.
(5)在虚线框中画出尾气吸收装置E并注明试剂.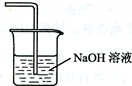
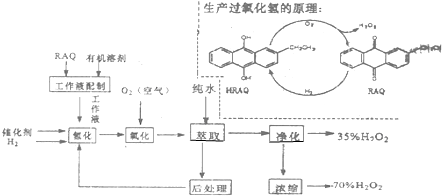
(6)用含有Al203、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O.工艺流程如下(部分操作和条件略)
Ⅰ.向铝灰中加入过量稀H2SO4,过滤
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
已知:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释步骤Ⅱ的目的:加入过量KMnO4溶液,将亚铁离子氧化为铁离子,调PH为了使铁离子完全转化为Fe(OH)3沉淀.

Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为2Fe+3Cl2 $\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是在沉积的FeCl3固体下方加热
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)②⑤
(4)装置B中冷水浴的作用为冷却,使FeCl3沉积,便于收集产品,装置C的名称为干燥管;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:酸性KMnO4溶液.
(5)在虚线框中画出尾气吸收装置E并注明试剂.

(6)用含有Al203、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O.工艺流程如下(部分操作和条件略)
Ⅰ.向铝灰中加入过量稀H2SO4,过滤
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
已知:金属离子的起始浓度为0.1mol•L-1
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
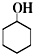
6.阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:

主要试剂和产品的物理常数
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解.
(2)合成阿斯匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离.
另一种改进的提纯方法,称为重结晶提纯法.方法如下:
(4)改进的提纯方法中加热回流的装置如图所示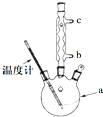
①使用温度计的目的是控制反应温度,防止温度过高,乙酰水杨酸受热分解.冷凝水的流进方向是b.(填“b”或“c”).
②重结晶提纯法所得产品的有机杂质要比原方案少的原因水杨酸易溶于乙酸乙酯,冷却结晶时大部分水杨酸仍溶解在乙酸乙酯中很少结晶出来.
(5)检验产品中是否含有水杨酸的化学方法是取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色,则含水杨酸.
(6)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为84.3%.
 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
主要试剂和产品的物理常数
| 名称 | 相对分子质量 | 熔点或沸点 (℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙烯水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是防止乙酸酐水解.
(2)合成阿斯匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产物中加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤,则加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离.
另一种改进的提纯方法,称为重结晶提纯法.方法如下:
(4)改进的提纯方法中加热回流的装置如图所示

①使用温度计的目的是控制反应温度,防止温度过高,乙酰水杨酸受热分解.冷凝水的流进方向是b.(填“b”或“c”).
②重结晶提纯法所得产品的有机杂质要比原方案少的原因水杨酸易溶于乙酸乙酯,冷却结晶时大部分水杨酸仍溶解在乙酸乙酯中很少结晶出来.
(5)检验产品中是否含有水杨酸的化学方法是取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色,则含水杨酸.
(6)该学习小组在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品m=2.2g,则所得乙酰水杨酸的产率为84.3%.
5.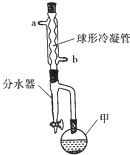 乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.
乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.
合成反应:
在甲中加入20g异戊醇和少量碎瓷片,在不断搅拌下加入2mL浓硫酸,冷却后加入100g稍过量的冰醋酸,再加入环己烷(能与产物形成共沸混合物,不参加反应).安装带有分水器(预装有一定量的水)的冷凝回流装置,球形冷凝管中通入冷却水,用甘油浴缓慢加热仪器甲,冷凝回流一段时间.
分离提纯:
将反应粗产品倒入分液漏斗中,分别用少量10% Na2CO3溶液分两次洗涤.分去水层,向有机层中加入无水硫酸镁固体,静置一段时间后分离出液体,最后蒸馏除去环己烷得到纯净的乙酸异戊酯13g.
已知下列物质的沸点和密度:
请回答下列问题:
(1)合成乙酸异戊酯的化学方程式为CH3COOH+(CH3)2CHCH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH(CH3)2+H2O.
(2)仪器甲的名称是圆底烧瓶.
(3)分水器可将仪器甲中产生的水分离出来,目的是提高反应物的转化率或生成物的产率;按照球形冷凝管中冷却水的流向应该由b(填“a”或“b”)口进水.
(4)本实验使用甘油浴加热的优点有便于控制反应温度、使圆底烧瓶受热均匀 (答出两点即可).
(5)当观察到分水器中出现水层高度(或水的体积、液面对应刻度)不再变化现象时,可停止加热仪器甲,终止合成反应过程.
(6)用10%Na2CO3溶液洗涤的作用是ad.
a、除去未反应完的醋酸 b、提高异戊醇的转化率
c、与异戊醇反应,除去杂质 d、降低乙酸异戊酯在水中的溶解能力
(7)本实验中无水硫酸镁的作用是作干燥剂.
(8)本实验中异戊醇的转化率为44%.
 乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.
乙酸异戊酯常作为配制香蕉、梨、苹果等多种口味食品的香料.实验室合成乙酸异戊酯的原料是乙酸和异戊醇[(CH3)2CHCH2CH2OH],其装置如图所示.合成反应:
在甲中加入20g异戊醇和少量碎瓷片,在不断搅拌下加入2mL浓硫酸,冷却后加入100g稍过量的冰醋酸,再加入环己烷(能与产物形成共沸混合物,不参加反应).安装带有分水器(预装有一定量的水)的冷凝回流装置,球形冷凝管中通入冷却水,用甘油浴缓慢加热仪器甲,冷凝回流一段时间.
分离提纯:
将反应粗产品倒入分液漏斗中,分别用少量10% Na2CO3溶液分两次洗涤.分去水层,向有机层中加入无水硫酸镁固体,静置一段时间后分离出液体,最后蒸馏除去环己烷得到纯净的乙酸异戊酯13g.
已知下列物质的沸点和密度:
| 甘油 | 环已烷 | 乙酸 | 异戊醇 | |
| 沸点/℃ | 290 | 80.7 | 117.9 | 132.5 |
| 密度/g•cm-3 | 1.26 | 0.78 | 1.05 | 0.81 |
(1)合成乙酸异戊酯的化学方程式为CH3COOH+(CH3)2CHCH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH(CH3)2+H2O.
(2)仪器甲的名称是圆底烧瓶.
(3)分水器可将仪器甲中产生的水分离出来,目的是提高反应物的转化率或生成物的产率;按照球形冷凝管中冷却水的流向应该由b(填“a”或“b”)口进水.
(4)本实验使用甘油浴加热的优点有便于控制反应温度、使圆底烧瓶受热均匀 (答出两点即可).
(5)当观察到分水器中出现水层高度(或水的体积、液面对应刻度)不再变化现象时,可停止加热仪器甲,终止合成反应过程.
(6)用10%Na2CO3溶液洗涤的作用是ad.
a、除去未反应完的醋酸 b、提高异戊醇的转化率
c、与异戊醇反应,除去杂质 d、降低乙酸异戊酯在水中的溶解能力
(7)本实验中无水硫酸镁的作用是作干燥剂.
(8)本实验中异戊醇的转化率为44%.
4.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
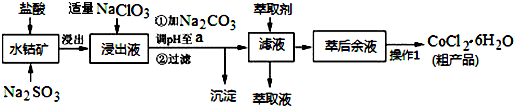
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)盐酸浸取水钴矿时为提高浸出率可采取的有效措施有研磨、搅拌、升温、适当增加酸的浓度、增加浸出时间(答一条即可),写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出该反应的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(2)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(3)“操作1”中包含3个基本实验操作,依次是蒸发(浓缩)、冷却(结晶)和过滤.
(4)萃取剂对金属离子的萃取率与pH的关系如图.其使用的最佳pH范围是B.
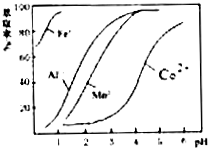
A.1.0~2.0 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)盐酸浸取水钴矿时为提高浸出率可采取的有效措施有研磨、搅拌、升温、适当增加酸的浓度、增加浸出时间(答一条即可),写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出该反应的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(2)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(3)“操作1”中包含3个基本实验操作,依次是蒸发(浓缩)、冷却(结晶)和过滤.
(4)萃取剂对金属离子的萃取率与pH的关系如图.其使用的最佳pH范围是B.

A.1.0~2.0 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
3.氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某化学研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计如图1实验装置.请回答:
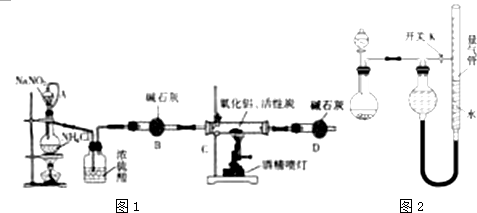
(1)按图连接好实验装置,检查装置气密性的方法是在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,说明气密性良好
(2)写出以下仪器的名称:A(恒压)分液漏斗 B干燥管
(3)实验中制取氮化铝(碳过量)的化学方程式为Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO
(4)化学研究小组的此装置存在严重缺陷,请说明改进的方法在干燥管D末端连一尾气处理装置
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气.
①量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水
c.煤油 d.饱和氯化铵溶液
②本实验应对量气管多次读数,读数时应注意:a.视线与凹液面最低处相平b.恢复至室温c.使量气管与干燥管两端液面相平
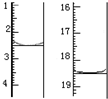
③实验获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
根据上述数据,可计算出样品中AlN的质量分数为61.5%.
0 171482 171490 171496 171500 171506 171508 171512 171518 171520 171526 171532 171536 171538 171542 171548 171550 171556 171560 171562 171566 171568 171572 171574 171576 171577 171578 171580 171581 171582 171584 171586 171590 171592 171596 171598 171602 171608 171610 171616 171620 171622 171626 171632 171638 171640 171646 171650 171652 171658 171662 171668 171676 203614

(1)按图连接好实验装置,检查装置气密性的方法是在干燥管D末端连接一导管,将导管插入烧杯中的液面下,用酒精灯微热蒸馏烧瓶,导管口有气泡冒出,撤掉酒精灯一段时间,导管内上升一段水柱,说明气密性良好
(2)写出以下仪器的名称:A(恒压)分液漏斗 B干燥管
(3)实验中制取氮化铝(碳过量)的化学方程式为Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO
(4)化学研究小组的此装置存在严重缺陷,请说明改进的方法在干燥管D末端连一尾气处理装置
(5)反应结束后,某同学用图2装置进行实验来测定氮化铝样品的质量分数(实验中导管体积忽略不计).已知:氮化铝和NaOH溶液反应生成NaAlO2和氨气.
①量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水
c.煤油 d.饱和氯化铵溶液
②本实验应对量气管多次读数,读数时应注意:a.视线与凹液面最低处相平b.恢复至室温c.使量气管与干燥管两端液面相平
③实验获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响):
| 编号 | 氮化铝样品质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 350.0mL | 13.7mL |
| ② | 1.0g | 350.0mL | 25.0mL |
| ③ | 1.0g | 350.0mL | 14.3mL |
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等.实验步骤中:在圆底烧瓶中加入10g乙醇、足量浓硫酸,然后加入研细的20.6g溴化钠和几粒碎瓷片.
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4℃,密度为1.43g/mL;可能存在的副反应有:加热反应过程中反应混合物会呈现黄色甚至红棕色;醇在浓硫酸的存在下脱水生成烯和醚等.实验步骤中:在圆底烧瓶中加入10g乙醇、足量浓硫酸,然后加入研细的20.6g溴化钠和几粒碎瓷片.